Правило "рычага" для растворов (вывод ищите в учебниках по физической химии, раздел "Фазовые равновесия" двухкомпонентных систем):
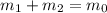
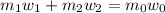
Концентрацию второго раствора находим из соотношений молярных масс соли и кристаллогидрата:
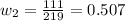
Концентрация соли в воде, очевидно, равна нулю. Следовательно, масса второго раствора будет равна:
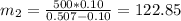 г.
г.
Масса чистой соли во втором растворе:
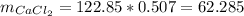 г.
г.
Количество вещества соли:
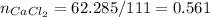 моль.
моль.
Объём второго раствора:
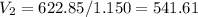 мл (0.542 л)
мл (0.542 л)
Отсюда находим молярность и нормальность раствора (фактор эквивалентности хлорида кальция равен 1/2):
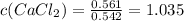 моль/л. [Молярность]
моль/л. [Молярность]
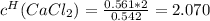 моль-экв/л. [Нормальность]
моль-экв/л. [Нормальность]
Соли:
ZnSO₄ - сульфат цинка, Ca(NO₃)₂ - нитрат кальция, Na₂CO₃ - карбонат натрия, CuCl₂ - хлорид меди, Ba(NO₃)₂ - нитрат бария;
Основания:
Ba(OH)₂ - гидроксид бария, Fe(OH)₃ - гидроксид железа;
Кислоты:
H₂SO₄ - серная кислота;
Оксиды:
MgO - оксид магния, MnO₂ - оксид марганца, SO₃ - оксид серы, P₂O₅ - оксид фосфора, CaO - оксид кальция;
Формулы:
FeO - оксид железа(II), P₂O₅ - оксид фосфора(V), Cr₂(SO₄)₃ - сульфат хрома(III), Cr(OH)₂ - гидроксид хрома(II), Pb(OH)₂ - гидроксид свинца(IV), Cu₂O - оксид меди (I), N₂O - оксид азота (I), PbSO₄ - сульфат свинца(II), Ca(OH)₂ - гидроксид кальция, H₃PO₄ - фосфорная кислота;
V(CO2) =22г
Объяснение:
Дано:
m(CO2) =22г
Найти: V(CO2) -?
V=n*Vm
n=m/M
M(CO2) =44г / моль
n=(CO2) =22г/44г/ Моль= 0.5
Моль
V(CO2)=0,5 моль*22,4 л/ моль= 11,2 Л