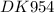находим молекулярную массу вещества:
mr = d(возд) х mr(возд) = 1,863 х 29 = 54
определяем сколько по массе приходится на водород. для этого составляем пропорцию:
100% - 54
11,1% - х
х = 6 (m (h))
определяем сколько по массе приходится на углерод:
m(c) = m(вещества) - m(h) = 54 - 6 = 49
вычисляем соотношение атомов с и н по формуле:
n = m/ar
n(c) = 49/12 = 4 атома
n(h) = 6/1 = 6 атомов
формула - с4н6 - бутин
проверка mr(c4h6) = 4ar(c) + 6ar(h) = 4 х 12 + 1 х 6 = 54
подробнее - на -
и не пиши что тут что-то не так. я учителем работаю и такую инфу я знаю.
Объяснение:
найти молекулярную формулу углеводорода, если относительная плотность его по водороду равна 41, массовая доля С равна 87,8%. Для найденного вещества написать 3-5 изомеров и назвать их,
Относительная молекулярная масса углеводорода равна 82.
если массовая доля углерода 87,8 %, то массовая доля водорода
100 - 87,8 = 12,2 %
n(C) = 87,8 г : 12 г/моль = 7,317 моль.
n(H) = 12,2 г : 1 г/моль = 12,2 моль
Простейшая формула С3Н5 Формульная масса 41 г/моль.
82г/моль : 41 г/моль. Переводной коэффициент равен 2. Следовательно все индексы в формуле надо умножить на 2.
Получаем истинную формулу С6Н10. Судя по формуле вещества и по насыщенности водородом в искомом углеводороде должны быть либо тройные связи: либо сдвоенные двойные связи.
СН2 = СН - СН = СН - СН2 - СН3 гексадиен -1,3
СН2 = СН - СН2 СН2 - СН = СН2 гексадиен - 1,5
СН3 - СН = СН - СН = СН - СН3 гексадиен -2,4
СН2 = С = СН - СН2 - СН2 - СН3 гексадиен-1,2
СН3 - СН = С = СН - СН2 - СН3 гексадиен-2,3
Дано:
[N₂]р. = 0,03 моль/л
[O₂]р. = 0,03 моль/л
[NO]р. = 0,02 моль/л
Найти:
Kравн. - ?
1) Для начала мы запишем уравнение реакций то что известно по условию задачи:
N₂(г.) + О₂(г.) ⇄ 2NO(г.)
2) Далее находим концентрацию равновесия из уравнения реакций::
Kравн. = [NO]р.²/([N₂]р. × [O₂]р.) = (0,02 моль/л)² / (0,03 моль/л × 0,03 моль/л) = 0,0004 (моль/л)² / 0,0009 (моль/л)² ≈ 0,44
ответ: Kравн. = 0,44
Решено от :