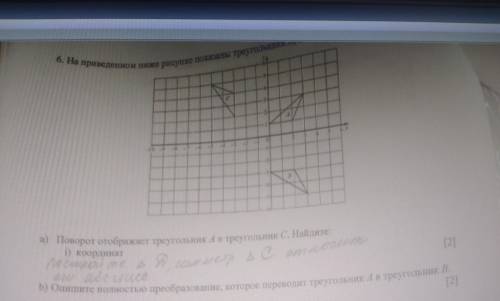
1. H⁺¹Br⁻¹ + H₂⁺¹S⁺⁶O₄⁻² → Br₂⁰ + S⁺⁴O₂⁻² + H₂⁺¹O⁻²
2Br⁻¹ - 2e⁻ → Br₂⁰ | 2 | | 1 | - восстановитель - окисление
| | 2 | |
S⁺⁶ + 2e⁻ → S⁺⁴ | 2 | | 1 | - окислитель - восстановление
В итоге получаем:
2HBr + H₂SO₄ → Br₂ + SO₂ + 2H₂O
2. K⁺¹Cl⁺¹O⁻² → K⁺¹Cl⁺⁵O₃⁻² + K⁺¹Cl⁻¹
Cl⁺¹ - 4e⁻ → Cl⁺⁵ | 4 | | 1 | - восстановитель - окисление
| | 4 | |
Cl⁺¹ + 2e⁻ → Cl⁻¹ | 2 | | 2 | - окислитель - восстановление
В итоге получаем:
3KClO → KClO₃ + 2KCl
3. Na₂⁺¹S⁺⁴O₃⁻² → Na₂⁺¹S⁻² + Na₂⁺¹S⁺⁶O₄⁻²
S⁺⁴ + 6e⁻ → S⁻² | 6 | | 1 | - окислитель - восстановление
| | 6 | |
S⁺⁴ - 2e⁻ → S⁺⁶ | 2 | | 3 | - восстановитель - окисление
В итоге получаем:
4Na₂SO₃ → Na₂S + 3Na₂SO₄
4. K⁺¹Cl⁻¹ + K⁺¹Mn⁺⁷O₄⁻² + H₂⁺¹S⁺⁶O₄⁻² → Cl₂⁰ + K₂⁺¹S⁺⁶O₄⁻² + Mn⁺²S⁺⁶O₄⁻² + H₂⁺¹O⁻²
2Cl⁻¹ - 2e⁻ → Cl₂⁰ | 2 | | 5 | - восстановитель - окисление
| | 10 | |
Mn⁺⁷ + 5e⁻ → Mn⁺² | 5 | | 2 | - окислитель - восстановление
В итоге получаем:
10KCl + 2KMnO₄ + 8H₂SO₄ → 5Cl₂ + 6K₂SO₄ + 2MnSO₄ + 8H₂O
5. Zn⁰ + H⁺¹N⁺⁵O₃⁻² → Zn⁺²(N⁺⁵O₃⁻²)₂⁻¹ + N₂⁺¹O⁻² + H₂⁺¹O⁻²
Zn⁰ - 2e⁻ → Zn⁺² | 2 | | 4 | - восстановитель - окисление
| | 8 | |
2N⁺⁵ + 8e⁻ → N₂⁺¹ | 8 | | 1 | - окислитель - восстановление
В итоге получаем:
4Zn + 10HNO₃ → 4Zn(NO₃)₂ + N₂O + 5H₂O
Решено от : 
У нас здесь гомогенная реакция, примем коэффициенты за концентрацию и произведем расчеты:
4 моль/л 5 моль/л 4моль/л 6моль/л
4NH₃ + 5O₂ = 4NO + 6H₂O
0,003моль/л х₁ 0,003моль/л х₂
х₁=0,00375 моль/л
исходная концентрация кислорода С(О₂) = 0,00375+0,00125=0,005 моль/л
х₂=0,0045 моль/л - это концентрация водяного пара в этот момент
ответ: С(Н₂О) = 0,0045 моль/л; исходная концентрация аммиака 0,012 моль/л; исходная концентрация кислорода - 0,005 моль/л