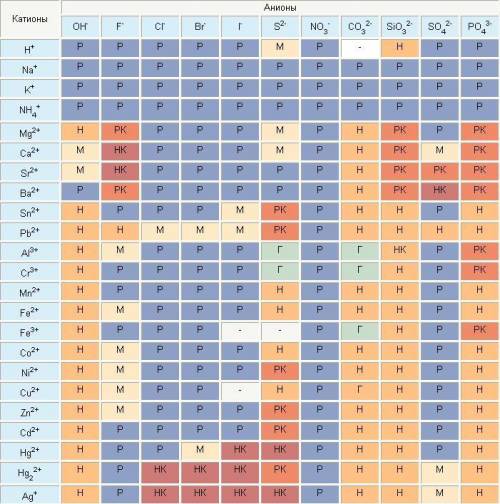
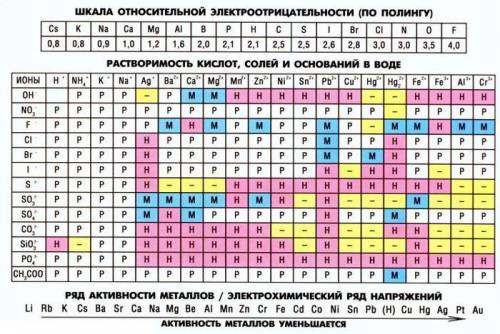
ниже. растворимость определяют по таблице
Объяснение:
1Раство́р — однородная система, в состав которой входят молекулы двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах. От механической смеси раствор отличается однородностью, от химического соединения — непостоянством состава.
2Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется.Это раствор, в котором растворенное вещество при данных условиях
(температура, давление)
достигло максимальной концентрации и больше не растворяется. Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным. НАСЫЩЕННЫЕ РАСТВОРЫ: соки фрэш,
Перенасыщенный раствор - раствор, в котором растворено большее количество вещества, чем в насыщенном растворе (сиропы, рапа)
Ненасыщенный раствор - раствор, содержащий меньше вещества, чем в насыщенном
3.Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. Например, можно определить массу вещества, которое выпадет в осадок из насыщенного раствора при его охлаждении.
4. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³).Растворимость газов в жидкости зависит от температуры и давления.
5.При повышении температуры растворимость твердых веществ обычно увеличивается, а газов - уменьшается.
Объяснение:
2KI + Cl2 = I2 + 2KCl
2I(-) -2e = I2(0) 1 ок-ие
в-ль
Cl2(0) +2e = 2I(-) 1 в-ие
ок-ль
2ZnS + 3O2 =2 ZnO + 2SO2
S(-2) -6e = S(+4) 2 ок-ие
в-ль
O2(0) +4e = 2O(-2) 3 в-ие
ок-ль
H2S + Br2 = 2HBr + S
S(-2) -2e = S(0) 1 ок-ие
в-ль
Br2(0) +2e = 2Br(-) 1 в-ие
ок-ль
Fe2O3 +3 C = 2Fe +3 CO
Fe(+3) +3e = Fe(0) 2 в-ие
ок-ль
C(0) -2e = C(+2) 3 ок-ие
в-ль
FeO + C = Fe + CO
Fe(+2) +2e = Fe(0) 1 в-ие
ок-ль
C(0) -2e = C(+2) 1 ок-ие
в-ль
Cu2O + C = 2Cu + CO
Cu(+) +1e = Cu(0) 2 в-ие
ок-ль
C(0) -2e = C(+2) 1 ок-ие
в-ль
ZnO + C = Zn + CO
Zn(2+) +2e = Zn(0) 1 в-ие
ок-ль
C(0) -2e = C(+2) 1 ок-ие
в-ль
MnO2 + 2C = Mn + 2CO
Mn(+4) +4e = Mn(0) 1 в-ие
ок-ль
C(0) -2e = C(+2) 2 ок-ие
в-ль
Fe2O3 + 3H2 = 2Fe + 3H2O
Fe(+3) +3e = Fe(0) 2 в-ие
ок-ль
H2(0) -2e = 2H(+) 3 ок-ие
в-ль
MoO3 + H2 = Mo + H2O
Mo(+6) +6e = Mo(0) 1 в-ие
ок-ль
H2(0) -2e = 2H(+) 3 ок-ие
в-ль
ответ: 3,97%
Дано:
ω(AgNO3) = 15%, или 0,15
Δm(пласт.) > на 22,65 г
m(p. Na2S) = 78 г
ω(Na2S) = 10%, или 0,1
m(p. NaOH) = 175 г
ω(NaOH) = 16%, или 0,16
Найти:
ω(NaNO3)-?
Объяснение:
M(AgNO3) = 170 г/моль
M(Zn(NO3)2)=189 г/моль
M(Ag) = 108 г/моль
M(Na2S) = 78 г/моль
M(ZnS) = 97 г/моль
M(NaNO3) = 85 г/моль
m(Na2S) = m(p. Na2S)*ω(Na2S) = 78 г*0,1 = 7,8 г
n(Na2S) = m(Na2S)/M(Na2S) = 7,8 г/78 г/моль = 0,1 моль
Составляем УХР1: 22,65 г
2AgNO3 + Zn = Zn(NO3)2 + 2Ag↓ Δm
340 г 189 г 216 г 27 г
m(Ag(NO3) = m(AgNO3)/ω(AgNO3) = 340 г*22,65 г/27 г = 285,22 г
m(p. AgNO3) = 285,22 г/0,15 = 1901,48 г
m(Zn(NO3)2) = 285,22 г*189 г/340 г = 158,55 г
m(Ag) = 285.22 г*216/340 г = 181,2 г
Составляем УХР2:
Zn(NO3)2 + Na2S = ZnS↓ + 2NaNO3
Из УХР2 видно, что n(Zn(NO3)2):n(Na2S):n(ZnS):n(NaNO3) = 1:1:1:2. Согласно расчетам по условию задачи:
n(Zn(NO3)2):n(Na2S):n(ZnS):n(NaNO3) = 0,1:0,1:0,1:0,2
m(Zn(NO3) = n*M = 0,1 моль*189 г/моль = 18,9 г
m(ZnS) = 0,1 моль*97 г/моль = 9,7 г
m(NaNO3) = 0,2 моль*85 г/моль = 17 г
m(NaOH) = m(p. NaOH)×ω(NaOH) = 175 г*0,16 = 28 г
Δm(Zn(NO3)2) = 158.55 г - 18,9 г = 139,65 г
m(NaOH) = 175 г*0,16 = 28 г
n(NaOH) = 28 г/40 г/моль = 0,7 моль
Составляем УХР3:
Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3
m(Zn(OH)2) = 0,5n(NaOH)*M(Zn(OH)2) = 0,5*0,7 моль*99 г/моль = 34,65 г
m'(NaNO3) = n(NaOH)*M(NaNO3) = 0,7 моль*85 г/моль = 59,5 г
∑m(NaNO3) = m(NaNO3)+m'(NaNO3) = 17 г + 59,5 г =76,5 г
Находим массу конечного р-ра:
m(p.) = m(p.AgNO3)+m(p.Na2S)+m(p.NaOH)-m(Ag)-m(ZnS)-m(Zn(OH)2)
m(p.) = 1901.48 г+78 г+175 г-181,2 г-9,7 г-34,65 г = 1928,93 г
ω(NaNO3) = ∑m(NaNO3)/m(p.) = 76,5 г/1928,93 г = 0,0397, или 3,97%
ответ: 3,97%