. Вы видите уравнения реакций. Все ли реакции относятся к реакциям разложения? Вычеркните лишнее. Найдите ошибку и дайте объяснение. За каждый правильный ответ 1б. 1) 2 H2O = 2H2 + O2
2) 2Na+Cl2=2NaCl
3) CaO+H2O =Ca(OH) 2
4) 2KMnO4 = K2 MnO4+ MnO2 + O2
5) 2H2 + O2 = 2 H2O
6) Cu(OH)2=CuO+H2O
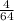 и
и 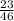
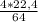
К реакциям разложения относятся пункты 146 (одно вещество разлагается на два+)
Оставшиеся 235 относятся к реакциям соединения (из двух+ веществ получаем одно)