BaCO3+2HCl=BaCl2+H2O+CO2
Na2CO3+2HCl=2NaCl+H2O+CO2
BaCl2+Na2SO4=BaSO4(осадок)+2NaCl
в осадок в результате обработки избытком сульфата натрия выпадает сульфат бария (идет только реакция с хлоридом бария, реакция с хлоридом натрия не идет)...
количество вещества сульфата бария, выпавшего в осадок: m(BaSO4)/M(BaSO4)=(46.6г)/(233г/моль)=0,2 моль
карбоната бария было также 0,2 моль...
зная количество вещества и молярную массу карбоната бария (197 г/моль), находим массу карбоната бария: 0,2*197=39,4 г.
теперь находим долю карбоната бария в его смеси с карбонатом натрия:
m(BaCO3)*100%/(m(BaCO3)+m(Na2CO3))=39.4*100/50=78.8%
Составляем уравнение реакции гидролиза крахмала, в результате которой образуется глюкоза:
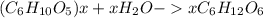
крахмал глюкоза
Рассчитаем массу крахмала в картофеле:
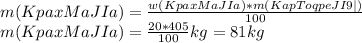
Определяем количество вещества крахмала:
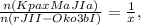
откуда получаем
n(глюкозы) = x∙n (крахмала)
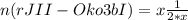 кмоль=0,5кмоль
кмоль=0,5кмоль
Вычисляем массу глюкозы, которую можно получить при количественном выходе:
m(глюкозы) = n(глюкозы)М(глюкозы); m(глюкозы) = 0,5∙180 кг = 90 кг.
Учитывая массовую долю выхода продукта, рассчитаем массу реально полученной глюкозы:
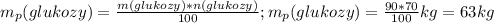
Задача:
Какова молярная концентрация эквивалента, моляльность и титр раствора щавелевой кислоты, полученной растворением 2,8 г H₂C₂O₄ × 2H₂O в мерной колбе вместимостью 500 мл?
Дано:
m(H₂C₂O₄ × 2H₂O) = 2,8 гр
V(р-ра H₂C₂O₄ × 2H₂O) = 500 мл = 0,5 л
Найти:
Сm(экв. H₂C₂O₄ × 2H₂O) - ?
Cm(H₂C₂O₄ × 2H₂O) - ?
T(H₂C₂O₄ × 2H₂O) - ?
1) Для начала мы найдем количества вещества щавелевой кислоты из кристаллогидрата:
M(H₂C₂O₄ × 2H₂O) = 1×2+12×2+16×4 + 2×(1×2+16) = 2+24+64 + 2×(2+16) = 90 + 2×18 = 90 + 36 = 126 гр/моль
n(H₂C₂O₄ × 2H₂O) = m(H₂C₂O₄ × 2H₂O) / M(H₂C₂O₄ × 2H₂O) = 2,8 гр / 126 гр/моль ≈ 0,022 моль
Cm(H₂C₂O₄ × 2H₂O) = n(H₂C₂O₄ × 2H₂O) / V(р-ра H₂C₂O₄ × 2H₂O) = 0,022 моль / 0,5 л = 0,044 моль/л = 0,044 М
2) Далее находим эквивалент щавелевой кислоты и потом молярную концентрацию эквивалента раствора щавелевой кислоты:
H₂C₂O₄ - щавелевая кислота , тогда:
H₂C₂O₄ ⇄ 2H⁺ + C₂O₄²⁻
fэкв.(H₂C₂O₄) = 1/n(H⁺) = 1/2
Сm(1/2 H₂C₂O₄ × 2H₂O) = Cm(H₂C₂O₄ × 2H₂O) / fэкв.(H₂C₂O₄) = 0,044 М / 1/2 = 0,044 М × 2 = 0,088 М
3) Теперь мы находим титр раствора щавелевой кислоты:
T(H₂C₂O₄ × 2H₂O) = (Cm(H₂C₂O₄ × 2H₂O) × M(H₂C₂O₄ × 2H₂O))/1000 = (0,044 М × 126 гр/моль)/1000 = (0,044 моль/л × 126 гр/моль)/1000 = 5,544 гр/л / 1000 = 0,005544 гр/мл ≈ 0,0055 гр/мл
ответ: Cm(H₂C₂O₄ × 2H₂O) = 0,044 М
Сm(1/2 H₂C₂O₄ × 2H₂O) = 0,088 М
T(H₂C₂O₄ × 2H₂O) = 0,0055 гр/мл
Решено от :