Дано:
m(раствораHBr)=162г.
ω%(HBr)=20%
NaOH
m(соли)-?
1. Определим массу чистой бромводородной кислоты:
m(HBr)=ω%(HBr)×m(раствораHBr)÷100%
m(HBr)=20%×162г.÷100%=32,4г.
2. Определим молярную массу бромводородной кислоты и ее количество вещества в 32,4г.:
M(HBr)=1+80=81г./моль
n₁(HBr)=m(HBr)÷M(HBr)
n₁(HBr)=32,5г.÷81г./моль=0,4моль
3. Запишем уравнение реакции:
2HBr+Zn(OH)₂=ZnBr₂+2H₂O
а)по уравнению реакции:
n(HBr)=2моль n(ZnBr₂)=1моль
б) по условию задачи:
n₁(HBr)=0,4моль n₁(ZnBr₂)=0,2моль
4. Определим молярную массу бромида цинка и его массу количеством вещества 0,2моль:
M(ZnBr₂)=65+2х80=225г./моль
m(ZnBr₂)=n₁(ZnBr₂)хM(ZnBr₂)
m(ZnBr₂)=0,2мольх225г./моль=45г.
5.ответ: при взаимодействии 162 г 20% раствора бромоводородной кислоты с гидроксидом цинка образуется 45г. соли бромида цинка.
а)NaOH - растворимое основание(щелочь)
б)H3PO4 - кислородсодержащая кислота
в)K2CO3 - соль
г)C2H2 - непредельный углеводород ряда ацетилена
д)ZnO - амфотерный оксид
е)CO2 - кислотный оксид
ж)Ca- металл
з)CH3COOH - карбоновая кислота
Тип связи в а)ионная, ж)металлическая, з)ионная
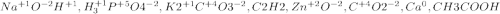
K2O+CO2=K2CO3
2KOH+CO2=K2CO3+H2O
K2O+H2CO3=K2CO3+H2O
KHCO3=K2CO3+H2O+CO2
3NaOH+H3PO4=Na3PO4+3H2O
2NaOH+ZnO=Na2ZnO2+H2O
2NaOH+CO2=Na2CO3+H2O
NaOH+CH3COOH=CH3COONa+H2O
3K2CO3+2H3PO4=2K3PO4+3H2O+3CO2
2H3PO4+3ZnO=Zn3(PO4)2+3H2O
3Ca+2H3PO4=Ca3(PO4)2+3H2
K2CO3+2CH3COOH=2CH3COOK+H2O+CO2
ZnO+CO2=ZnCO3
ZnO+2CH3COOH=(CH3COO)2Zn+H2O
N(+5)+1e=N(+4) 2 окислитель, восстановление