•Оксид азота (II) NO – бесцветный газ, не обладающий ни кислотными, ни основными свойствами. ...
••Оксид азота (IV) NO2 – бурый газ с характерным запахом. ...
••Оксид азота (I), или закись азота, N2O – бесцветный газ без запаха.
В кислородных соединениях азот проявляет различные степени окисления и образует пять оксидов: N2O, NO, N2O4, NO2 и N2O5. ... Оксиды N2O и NO – бесцветные газы, оксид азота (IV) NO2 – бурый газ. Оксид азота (III) N2O3 – синяя жидкость, оксид азота (V) N2O5 – бесцветные кристаллы.
Задание 1)
Формула количества вещества:
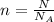 :
:
N — количество частиц вещества (молекул, атомов, ионов).
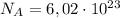 моль ⁻¹ — постоянная Авогадро.
моль ⁻¹ — постоянная Авогадро.
Найдем количество вещества атомов фосфора:
n (P) = 300 ∙ 10²³ : 6,02 ∙ 10²³ = 49,8 (моль).
Задание 2)
Формула количества вещества:
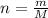 :
:
m — масса вещества.
M — его молярная масса.
Молярная масса оксида меди зависит от валентности входящей в его состав меди.
Найдем молярную массу оксида меди (|). Его формула Cu₂O.
M (Cu₂O) = 2 ∙ Ar (Cu) + Ar (O) = 2 ∙ 64 + 16 = 144 (г/моль).
Найдем молярную массу оксида меди (||). Его формула CuO.
M (CuO) = Ar (Cu) + Ar (O) = 64 + 16 = 80 (г/моль).
Теперь найдем количество вещества.
n (Cu₂O) = m (Cu₂O) : M (Cu₂O) = 20 : 144 = 0,14 (моль).
n (CuO) = m (CuO) : M (CuO) = 20 : 80 = 0,25 (моль).
ответ: 1) 49,8 моль; 2) 0,14 моль, если речь об оксиде меди (|) или 0,25 моль, если речь об оксиде меди (||).
Объяснение:
Хімічні індикатори - це органічні та неорганічні речовини, що використовуються для визначення водневого показника pH або встановлення кінцевої точки титрування (зазвичай зміни кольору). Хімічні індикатори дозволяють визначити закінчення хімічної реакції чи концентрацію водневих іонів. Хімічні індикатори можуть реагувати вплив одного, кількох чи всіх критичних параметрів реакції. Для проведення дослідження індикатор необхідно ввести в аналізований розчин. При використанні індикаторного паперу не слід опускати його в розчин, для цього буде достатньо невеликої краплі речовини, нанесеної на індикаторну смужку. Хімічні індикатори переважно використовують у титриметричному аналізі визначення кінцевої точки титрування. У ній у присутності індикатора може ігатися зміна кольору, свічення розчину тощо.
Індикатори застосовують також для визначення реакції розчинів (фільтрований папір, просочений відповідним індикатором). Розрізняють п'ять видів хімічних індикаторів: кислотно-основні індикатори змінюють своє забарвлення при зміні pH середовища (напр., фенолфталеїн, лакмус); індикатори окислювально-відновлювальні, хімічні сполуки, що змінюють забарвлення розчину в залежності від значення окислювально-відновного потенціалу (наприклад, метиленовий синій); комплексонометричні індикатори утворюють з іонами, що визначаються, пофарбовані комплексні сполуки; адсорбційні індикатори – речовини, у присутності яких відбувається зміна кольору осаду; хемілюмінесцентні індикатори - речовини, здатні за певних значень pH висвічувати видимим світлом.