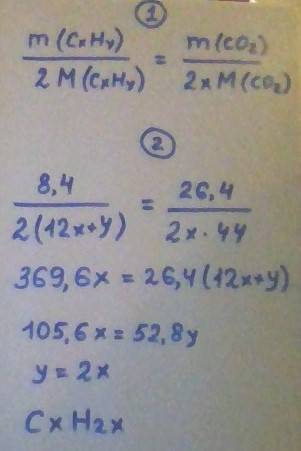
1) Теплота образования — тепловой эффект химической реакции образования 1 моля данного химического соединения из простых веществ.
2) Уравнение реакции:
2Zn + O₂ → 2ZnO
Так как теплота образования относится к 1 молю вещества, то разделим все коэффициенты в уравнении на 2:
Zn + 0,5O₂ → ZnO
1 моль любого газа при н.у. занимает объём 22,4 л, значит 0,5 моль О₂ занимает объем 11,2 л
3) По уравнению реакции составляем пропорцию:
5,6 л О₂ 175,3 кДж тепла
11,2 л О₂ Х кДж тепла
Х = 11,2*175,3/5,6 = 350,6
ответ: 350,6 кДж/моль
Zn (цинк)
C (вуглець)
Al (алюміній)
K (калій)
Речовини, які належать до складних:
O2 (кисень)
CaO (оксид кальцію)
H3PO4 (фосфорна кислота)
Na2CO3 (карбонат натрію)
KOH (гідроксид калію)
CuSO4 (сульфат міді)
Формули оксидів:
NaOH (гідроксид натрію)
BaO (оксид барію)
Al2O3 (оксид алюмінію)
FeO (оксид заліза)
CO (оксид вуглецю)
Формули кислот:
H2CO3 (карбонова кислота)
HNO3 (нітратна кислота)
Рівняння взаємодії кисню з простими речовинами:
Zn + O2 → ZnO (цинк + кисень → оксид цинку)
C + O2 → CO2 (вуглець + кисень → діоксид вуглецю)
4Al + 3O2 → 2Al2O3 (алюміній + кисень → оксид алюмінію)
4K + O2 → 2K2O (калій + кисень → оксид калію)
Відповідні оксиди та гідрати оксидів:
Ba + O2 → BaO (оксид барію)
BaO + H2O → Ba(OH)2 (гідроксид барію)
S + O2 → SO2 (оксид сірки)
SO2 + H2O → H2SO3 (сульфітна кислота)
Маса кальцій гідроксиду у розчині: 40 г
Маса розчину: 160 г
Масова частка кальцій гідроксиду у розчині:
(40 г / 160 г) * 100% = 25%
Масова частка оксигену найбільша в сполуці N2O5.