Объяснение:
сколько мл 0,1 нормального раствора гидроксида натрия потребуется для титрования 5 мл 0,05 молярного раствора серной кислоты
Для начала сделаем перерасчет молярного раствора серной кислоты в нормальный раствор серной кислоты: тогда 0,05 М раствор численно равен 0,1 Н раствору
Таким образом на титрование 0,1 н раствора щелочи пойдет 5 мл 0,1 н раствора серной кислоты либо 10 мл 0,05н раствора серной кислоты. в любом случае объем щелочи при титровании 5 мл.
 моль
моль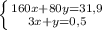
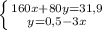

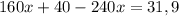

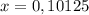 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)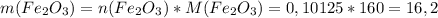 г
г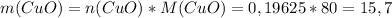 г
г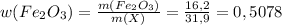 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)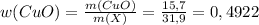 или 49,22%
или 49,22%
Відповідь:
Пояснення:
Вычислим массу гидроксида калия, реагирующего с 27% 120 г уксуса.
Для реакции гидроксида калия с уксусной кислотой необходимо определить массу гидроксида калия, реагирующего с 120 г уксусной кислоты массовой долей 27%.
Сначала определим массу уксусной кислоты в растворе:
Масса уксусной кислоты = масса раствора × массовая доля уксусной кислоты
Масса уксусной кислоты = 120 г × 0,27 = 32,4 г
Затем, используя реакционное уравнение между гидроксидом калия (KOH) и уксусной кислотой (CH3COOH), известно, что соотношение между ними равно 1:1.
Следовательно, масса гидроксида калия, реагирующего, также будет равна 32,4 г.
Таким образом, получаемая масса гидроксида калия, реагирующего с 27% 120 г уксусной кислоты, составляет 32,4 г.