Объяснение:
Положение унуненнего в качестве седьмого щелочного металла, позволяет предположить, что он будет иметь свойство, аналогичные свойства его более легкие сородич : лития, натрий, калий, рубидий, цезий и франция.
Вот основные свойства допустим натрия:
Щелочной металл на воздухе легко окисляется до оксида натрия. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.
4Na + O2 → 2Na2O
При горении на воздухе или в кислороде образуется пероксид натрия:
2Na + O2 →to Na2O2
Кроме того, существует озонид натрия NaO3.
С водой натрий реагирует очень бурно, помещённый в воду кусочек натрия всплывает, из-за выделяющегося тепла плавится, превращаясь в белый шарик, который быстро движется в разных направлениях по поверхности воды, реакция идёт с выделением водорода, который может воспламениться. Уравнение реакции:
2Na + 2H2O → 2NaOH + H2↑
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, йода, углерода, благородных газов):
2Na + Cl2 → 2NaCl
2Na + H2 →250−400oC,p 2NaH
Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития):
6Na + N2 → 2Na3N
С разбавленными кислотами взаимодействует как обычный металл:
2Na + 2HCl → 2NaCl + H2↑
С концентрированными окисляющими кислотами выделяются продукты восстановления:
8Na + 10HNO3 → 8NaNO3 + NH4NO3 + 3H2O
Растворяется в жидком аммиаке, образуя синий раствор:
Na + 4NH3 →−40oC Na[NH3]4
С газообразным аммиаком взаимодействует при нагревании:
2Na + 2NH3 →350oC 2NaNH2 + H2
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой. При недостатке металла происходит реакция Вюрца.
Реагирует со спиртами, фенолами, карбоновыми кислотами с образованием солей.
Растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1).
Объяснение:
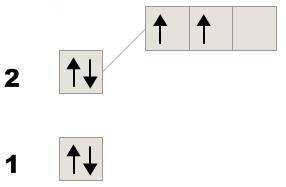
Якщо електрони у першого розміщенні на 2 енергетичних рівнях, значить це елемент другого періоду. Всього на зовнішньому рівні елементів другого періоду може бути 8 електронів, тому робимо висновок, що цей елемент має 4 електрони і ще 4 йому треба, щоб завершити рівень
Значить це Карбон (електронно-графічна формула рис. 1)
У другого елемента енергетичних рівнів на 2 більше, значить всього їх 4, тобто це елемент 4 періоду. Якщо для завершення зовнішнього рівня не вистачає 2 електрони, значить вже є 6
Значить це Селен (електронно-графічна формула рис. 2)
Відповідь:
Пояснення:
H2SO4 + 2KOH -> K2SO4 + 2H2O
З цього рівняння можна бачити, що для нейтралізації однієї молекули H2SO4 потрібно дві молекули KOH. Тому коефіцієнт пропорційності між масами H2SO4 і KOH дорівнює 1:2.
маса KOH дорівнює 13 кг, то маса H2SO4, необхідна для нейтралізації, буде половиною від маси KOH, тобто 13 кг / 2 = 6.5 кг.
Щоб визначити кількість утвореної солі, слід знати масові співвідношення між H2SO4 і K2SO4. Це залежить від молярних мас речовин. Але дані про молярні маси в задачі не вказані, тому не можна точно відповісти на це питання.
Щодо об'єму води, то воду утворюється у такому ж молевому співвідношенні, як H2SO4 і KOH. Тобто, для кожної молекули H2SO4, яку ми нейтралізуємо, утворюються дві молекули води. Проте, конкретний об'єм води залежить від маси використаної H2SO4 та її концентрації, які не вказані в задачі. Тому ми не можемо точно визначити об'єм води.