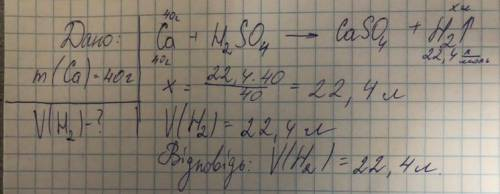
22,37 л
Объяснение:
Для розрахунку об'єму виділеного водню, потрібно визначити кількість молей кальцію (Ca) і сульфатної кислоти (H2SO4), які реагують, а потім порівняти їх для визначення обмежуючого реагента.
Знайдемо кількість молей кальцію:
Молярна маса Ca = 40,08 г/моль
Маса Ca = 40 г
Кількість молей Ca = маса Ca / молярна маса Ca
Кількість молей Ca = 40 г / 40,08 г/моль ≈ 0,998 моль
Знайдемо кількість молей сульфатної кислоти:
Молярна маса H2SO4 = 98,09 г/моль
Маса H2SO4 - невідома (відсутня у запитанні), тому ми не можемо точно визначити кількість молей H2SO4.
За реакцією між Ca і H2SO4 утворюється водень (H2):
Ca + H2SO4 -> CaSO4 + H2
Щоб визначити обмежуючий реагент, порівняємо кількість молей Ca з кількістю молей H2SO4. Коефіцієнт молекулярного співвідношення між Ca і H2SO4 в рівнянні реакції дорівнює 1:1.
Оскільки кількість молей Ca (0,998 моль) більша, ніж кількість молей H2SO4 (невідома), це означає, що H2SO4 є обмежуючим реагентом.
Кількість молей H2, яка утворюється, також буде 0,998 моль, оскільки відповідно до рівняння реакції коефіцієнт співвідношення між Ca і H2 дорівнює 1:1.
Для визначення об'єму водню (H2), використаємо мольний об'єм газу при нормальних умовах (н.у.), який становить приблизно 22,4 л/моль.
Об'єм H2 = кількість молей H2 * мольний об'єм газу
Об'єм H2 = 0,998 моль * 22,4 л/моль
Об'єм H2 ≈ 22,37 л
Таким чином, об'єм водню, який виділяється при взаємодії 40 г Ca з сульфатною кислотою, становить приблизно 22,37 л (при нормальних умовах).
а)Mr(FeO)=56+16=72
ω(Fe)=56÷72=0,778 ω%(Fe)=0,778×100%=77,8%
ω(O)=16÷72=0,222 ω%(O)=0,222×100%=22,2%
б)Mr(P₂O₅)=31x2+16x5=62+80=142
ω(P)=62÷142=0,437 ω%(P)=0,437×100%=43,7%
ω(O)=80÷142=0,563 ω%(O)=0,563×100%=56,3%
Mr(Na₂CO₃)=23x2+12+16x3=46+12+48=106
ω(Na)=46÷106=0,434 ω%(Na)=0,434×100%=43,4%
ω(C)=12÷106=0,113 ω%(C)=0,113×100%=11,3%
ω(O)=48÷106=0,453 ω%(O)=0,452×100%=45,3%
Mr[AI₂(SO₄)₃=54+96+192=342
ω(AI)=54÷342=0,158 ω%(AI)=0,158×100%=15,8%
ω(S)=96÷342=0,281 ω%(S)=0,281×100%=28,1%
ω(O)=192÷342=0,561 ω%(O)=0,561×100%=56,1%