Задача №1
- Уравнение:
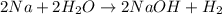
- вычислим количество вещества водорода:
n = V/Vm = 4,48л/22,4л/моль = 0,2 моль
- По уравнению реакции:
n(Na) = 2n(H2) = 0.2моль*2 = 0,4 моль
- Вычисляем массу натрия:
m(Na) = n*M = 0,4моль*23г/моль = 9,2 грамма
Отвеот: масса натрия равна 9,2 грамма
Задача №2
- Уравнение:
CuO + H2 = Cu + H2O
-По уравнению реакции, видим, что:
n(H2) = n(CuO) = 1,5 моль
- Масса 1,5 моль водорода:
m= n*M = 2г/моль*1,5моль = 3 грамма
- По уравнению реакции, видим, что:
n(Cu) = n(CuO) = 1.5 моль
- Рассчитывеам массу 1,5 моль меди:
m = n*M = 1,5 моль*64г/моль = 96 грамм
Объяснение:
К пятой аналитической группе катионов относятся ионы Fe2+, Fe3+, Mn2+, Mg2+, Ионы Мn2+ и Mg2+ - бесцветные, ионы Fe2+ - бледно-зеленые, а ионы Fe3+— желтые. Нитраты, сульфаты и хлориды катионов этой группы хорошо растворимы в воде. Гидроксиды катионов этой группы слабые труднорастворимые электролиты. Они не растворяются в избытке щелочи и в растворе аммиака, чем отличаются от гидроксидов четвертой и шестой групп. Групповым реагентом является NaOH.
Все соли катионов пятой аналитической группы подвергаются гидролизу, особенно соли железа (III).
Б) Сера (+4) ответ: 1
В) Хлор (-1) ответ: 2,3
Г) Марганец (+7) ответ: 4
Д) углерод (+2) ответ: 5