Простые вещества ,рядом с которыми ничего не стоит имеют степень окисления - 0
а) AlF3 Al(+3) F(-); BaCl2 Ba(+2) Cl(-); CaS Ca(+2) S(-2); K3P K(+) P(-3); SnO2 Sn(IV) O(II).
б) I2(0); N2O3 N(+3) O(-2); PbCl4 Pb(+4) Cl(-); Cl2O7 Cl(+7) O(-2); SbCl3 Sb(+3) Cl(-)
в) ClF3 Cl(+3) F(-); NaF Na(+) F(-); P4(0); FeI2 Fe(+2) I(-); MgS Mg(+2) S(-2).
г) CF4 C(+4) F(-); Ca(0); CS2 C(+4) S(-2); Al4C3 Al(+3) C(-4); PCl5 P(+5) Cl(-).
д) FeS Fe(+2) S(-2); IBr I(+) Br(-); TeCl4 Te(+4) Cl(-); SF6 S(+6) F(-); NF3 N(+3) F(-).
е) CS2 C(+4) S(-2); XeO4 Xe(+8) O(-2); CCl4 C(+4) Cl(-); PCl5 P(+5) Cl(-); Mn2O7 Mn(+7) O(-2)
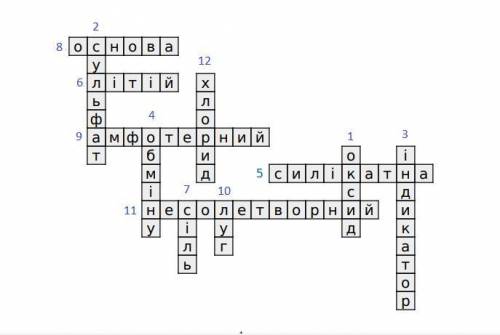
1. Бінарна сполука, що складається з двох елементів, одним з яких є оксиген.
2. Кислотний залишок солі BaSO₄.
3. Речовина, за до якої виявляють луг та кислоту.
4. Реакція, у ході якої дві речовини обмінюються своїми частинами.
5. Кислота, яка не розчинна у воді.
6. Метал, який найбільш за інших взаємодіє з кислотами.
7. Речовина, що утворюється при взаємодї кислотного та основного оксидів.
8. Сполука металічного елементу й гідроксильної групи OH.
9. Гідроксид, що виявляє властивості і кислот, і основ.
10. Розчинний гідроксид.
11. Оксид, якому не відповідає ані кислота, ані основа.
12. Назва кислотного залишку найпоширенішої солі.
Объяснение:
соединения это молекулы сложные
простые вещества один вид атома например H2 только из Н простой
или Н2О из Н и О два вида сложная
реакция-это межмолекулярное взаимодействие с молекулой другого состава
типы
замещения
обмена
горения
присоединения