2. m(молекулы CO2) - ?
M(CO2) = 44 g / mol
NA = 6.02*10^23 молекул
m(молекулы CO2) = 44 / 6.02*10^23 = 7.308*10^-23 грамм
3.m(р-ну) = 200 g
W(CuSO4) = 10%
m(H2O) - ?
m(CuSO4) - ?
m(H2O) = 200 - 0.1*200 = 180 g
m(CuSO4) = 200 * 0.1 = 20 g
4. Mr(Me(OH)3) = 78.
Ar(Me) = 78 - 16*3 - 1*3 = 78 - 51 = 27.
Алюминий - Al
5. CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
MgCl2 + K2CO3 → 2KCl + MgCO3
CaCO3 + 2HCl = CaCl2 + H2CO3
Ионную не знаю, сорян.
6.m(Me) = 2 g
N(H2) = 0.05 mol
Me - ?
x mol 0.05 mol
Me + 2H2O = Me(OH)2 + H2
1 mol 1 mol
1:x = 1:0.05
x = 0.05
M(Me) = 2 / 0.05 = 40 g / mol
Это Кальций - Ca
В порции озона. 3,6*10^20 против 2,4*10^13.
Объяснение:
Итак, основная формула - применяемая в этой задаче
N = 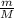 *Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
*Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
Для озона все проще - 0,0096 г/46 г/моль * 6,022*10^23 моль⁻1, ≈ 1,2044*10^20
Для кислорода все на шаг дольше, поскольку дан объем, а не масса. Эти две величины связаны соотношением V = 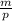 , отсюда m = V*p
, отсюда m = V*p
N = 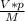 *Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
*Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
В молекуле озона - три атома, кислорода - два атома. 3,6*10^20 против 2,4*10^13. Очевидно, в данной порции озона атомов больше, чем в данной порции кислорода.
Я не применял формулу 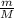 =
= 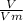 ; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
ответ: Б и Г