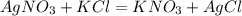
M(AgNO3)=170 г/моль
M(KCl)=74,5 г/моль
n(AgNO3)=m/M
n(AgNO3)=25,5/170
n(AgNO3)=0,15моль
n(KCl)=11,92/74,5
n(KCl)=0,16моль
С уравнения реакции видно, что n(AgNO3):n(KCl)=1:1
значит KCl находится в избытке, а AgNO3 в недостаке
по AgNO3 ведём расчёт.
n(AgNO3)=n(AgCl)=0,15моль
M(AgCl)=143,5
m(AgCl)=M*n
m(AgCl)=143,5*0,15
m(AgCl)=21,525 грамм.
Количество вещества KCl, которое вступит в реакцию с AgNO3 должно быть 0,15 моль.
Находим массу KCl, которая вступила в реакцию.
0,15моль=m/74,5
m=11,175
11,92-11,175=0,745 грамм
ответ: масса образовавшегося осадка - 21,525 грамм. В избытке хлорид калия на 0,745 грамм больше, чем надо.
48 г 38,4л,х л у моль
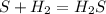
32 г 22,4 л 1 моль
1,5 моль 147,2 г,k г l г m г
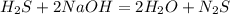
1 моль 80 г 36 г 78 г
1. По первому уравнению находим сначала,какое из исходных веществ прореагировало полностью(без остатка),приняв объем водорода за Х:
для полного взаимодействия 32 г серы необходимо 22,4 л водорода, а
для -- // -- 48 г________________х г, откуда
х=48*22,4/32=33,6 л
2. Так как объем водорода дан в избытке,то количество вещества сероводорода находим по массе серы:
при взаимодействии 32 г серы образуется 1 моль сероводорода,а
при -- // -- 48 г_______________у моль, откуда
у=48*1/32=1,5 моль
3. Подставим это количество вещества во второе уравнение.
4. Теперь найдем чистую масу гидроксида натрия в данном растворе:
m1(NaOH)=m1(раствора)*w(NaOH)=640*0,23= 147,2 г
5. теперь снова проверим,какое из исходных веществ прореагирует без остатка,приняв массу гидроксида за k:
для полного взаимодействия 1 моль сероводорода необходимо 80 г гидроксида,а
для -- // -- 1,5 моль______________________k, откуда
k=1,5*80/1=120 г
6. Из этого следует,что гидроксид дан в избытке,значит массу соли находим по количеству вещества сероводорода:
при взаимодействии 1 моль сероводорода образуется 78 г соли, а
при -- // -- 1,5 моль_____________________m г, откуда
m=1,5*78/1=117 г
7. Кроме соли одним из компонентов раствора соли будет вода,которая образовалась в результате реакции,вот и найдем ее массу и снова через количество вещества сероводорода:
при взаимодействии 1 моль сероводорода образуется 36 г воды, а
при -- // -- 1,5 моль______________________l г, откуда
l=1,5*36/1=54 г
8. Еще одним компонентом раствора соли есть вода,из которой состоял раствор гидроксида натрия,его массу тоже находим:
m2(H2O)=m1(раствора)-m1(NaOH)=640-147,2=492,8 г
9. К раствору соли примыкает также не прореагировавший гидроксид натрия,массу которого находим отниманием массы необходимого гидроксида от массы общей,которая была в растворе:
m2(NaOH)=147,2-120=27,2 г
10. Для определения массовой доли соли нам необходима масса раствора,который состоит собственно из соли,образовавшейся воды в результате реакции,воды оставшейся от раствора гидроксида и не прореагировавшего гидроксида:
m2(раствора)=m(Na2S)+m1(H2O)+m(H2O)+m2(NaOH)=117+54+492,8+27,2=691 г
11. А теперь отнеся массу соли к массе всего этого раствора,и получим массовую долю соли в нем:
w(Na2S)=m(Na2S)/m2(раствора)=117/691=0,169 или 16,9%
Кислота+me=соль+H2
2HCl+Mg=MgCl2+H2