Определить строение кислородсодержащего органического соединения, 18 г которого могут прореагировать с 23,2 г оксида серебра (аммиачного раствора), а объем кислорода, необходимый для сжигания такого же количества этого вещества, равен объему образующегося при его сгорании со2 (при н. у.)
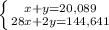
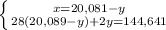
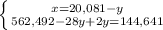
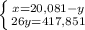
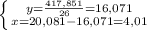
Из данных задачи следует, что искомое вещество содержит альдегидную группу и одинаковое число атомов С и О. Это может быть углевод СnH2nOn. Уравнения реакций его окисления и горения:
CnH2nOn+Ag2O->CnH2nOn+1+2Ag
CnH2nOn+nO2->nCO2+nH20
Из уравнения реакции (1) молярная масса углевода:
x = 18•232/23,2 = 180 г/моль,
М(СnH2nOn) = 12n + 2n + 16n = 180, n = 6.