у г 25 г
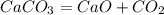
100 г 56 г
1. Сначала найдем теоретически возможный выход извести:
20 г извести - это только 80% от теоретически возможного, а
х г__________________100 г, откуда х=20*100/80=25 г
2. Подставив эту массу в уравнение реакции,найдем истинную массу карбоната,который прокалили:
при прокаливании 100 г карбоната образуется 56 г извести, а
при --//--//-- у г___________________25 г, откуда у=100*25/56=приблизительно 45 г
ответ:
объяснение:
2 so2 (газ) + o2 (газ)= 2 so3 +q
если объяснить по простому, то + идет всегда к - и наоборот. то есть при увеличении равновесии смещается в сторону того, чего меньше.
а) при повышении температуры равновесие сместится в сторону продуктов реакции(←). так как в правой стороне стоит ( +q), то равновесие смещается в сторону меньшего.
б) при понижении давления равновесие сместится тоже в сторону продуктов реакции(←). так как в левой стороне объем продуктов равен 3, а в правой 2 (сумма коэффициентов).