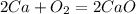
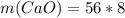
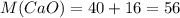
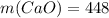
Мы знаем, что у кислорода степень окислени постоянная, равна -2 (кроме фторида кислорода и пероксидов), а у неизвестного элемента +3, значит оксид можно в общем виде записать так:
R2O3 - под такой оксид попадают - металлы третьей группы, главной подгруппы, элементы с переменной степенью окисления, а ткаих много, значит методом подбора долго будем решать, давайте по другому попробуем.
Мы знаем массовую долю этого элемента, значит можем узнать массовую долю кислорода:
100% - 69,62% = 30,38%
Далее, зная, сколько у нас кислорода в соединении и зная его массовую долю, попробуем найти молекулярную массу всего оксида, через массовую долю кислорода:
- запишем формулу для нахождения молекулярной массы, через массовую долю:
Mr =nAr(O)/ w(в долях) - здесь n - количество кислорода в соединении
поехали, подставляем и получаем:
3*16/0,3038 = 157,9986833 ~ 157,9
Дальше, молекулярную массу R2O3 (ее нахождение) запишем формулой: Mr = nAr(Met) + mAr(O)
Подставляем полученные значения:
157,9 = 2n(Met) + (3*16)
157,9 - 48 = 2n(Met)
109,9 = 2n(Met)
n(Met) = 54,94
Металл - марганец, оксид - Mn2O3 - оксид марганца(III)
- Уравнения:
а. CaC2 + 2H2O = C2H2 + Ca(OH)2
б. C2H2 + 2Ag[(NH3)2]OH = Ag2C2 + 4NH3 + 2H2O, Ag[(NH3)2]OH - аммиачный раствор оксида серебра.
- Рассчитаем количество вещества ацетелинида:
n = m/M = 15.6грамм/240г/моль = 0,065 моль
- По уравнению реакции (б):
n(C2H2) = n(Ag2C2) = 0.065 моль
- По уравнению реакции (а):
n(CaC2) = n(C2H2)) = 0,065 моль
- Масса 0,065 моль карбида кальция:
m=n*M = 64г/моль*0,065моль = 4,16 грамм
- Массовая доля карбида в смеси:
w = mч.в./mсмеси*100% = 4,16грамм/5грамм*100% = 83,2%