1)Определение Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов).
2)Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху: Алгебраическая сумма степеней окисления всех атомов в комплексном ионе (катионе либо анионе) должна быть равна его общему заряду (см.
Объяснение:
Пишем кинетическое уравнение для прямой реакции до увеличения объема
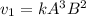
Пишем кинетическое уравнение для обратной реакции до увеличения объема
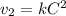
Пишем кинетическое уравнение для прямой реакции после увеличения объема (если объем увеличился в 2 раза, то концентрации веществ уменьшились во столько же)
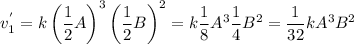
Пишем кинетическое уравнение для обратной реакции после увеличения объема (если объем увеличился в 2 раза, то концентрации веществ уменьшились во столько же)
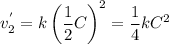
Считаем во сколько раз уменьшится скорость прямой реакции
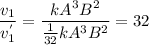
Считаем во сколько раз уменьшится скорость обратной реакции
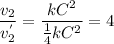
Делаем вывод: если прямая реакция замедлилася в 32 раза, а обратная только в 4, то равновесие сместится влево (в сторону исходных веществ). Это согласуется и с принципом Ле Шателье.
2) Г
3) А
4) В
5) А
6) Б
7) В
8) Б
9) А
10) А
11)
а) K2CO3 + H2O -> KHCO3 + KOH (щелочная среда из-за аниона гидроксогруппы)
б) AlCl3 + H2O -> Al(OH)Cl2 + HCl (кислая среда из-за катиона водорода)
в) Na2SO4 + H2O -> реакция не идёт (среда нейтральная)
12) CH3-COOC2H5 + H2O -> CH3-COOH + C2H5OH
увеличить концентрацию этилацетата
уменьшить концентрацию уксусной кислоты\этилового спирта
12) В жесткой воде протекают реакции обмена, в результате которых образуются кальциевые и магниевые соли тех же кислот, которые, в отличие от натриевых, не растворяются в воде и не обладают поверхностно-активными свойствами.
2C17H35COONa + Ca(HCO3)2 -> Ca(C17H35COO)2 + 2NaHCO3
Вроде так.