Дано: m(SO₃) = 20 грамм, η(NaOH) = 12 % – концентрация раствора.
Уравнение реакции: SO₃ + 2NaOH → Na₂SO₄ + H₂O
молярная масса SO₃: М(SO₃) = 32 + 3·16= 32 + 48 = 80 г/моль,
молярная масса NaOH: М(NaOH) = 23 + 16 + 1 = 40 г/моль,
количество вещества оксида серы VI:
ν(SO₃) = m(SO₃) : М(SO₃) = (20 г) : (80 г/моль) =  = 0,25 моль.
= 0,25 моль.
SO₃ + 2NaOH → Na₂SO₄ + H₂O. На один моль оксида серы VI приходится два моля гидроксида натрия ⇒ ν(NaOH) = 2ν(SO₃) = 2·0,25 = 0,5 моль;
масса NaOH равна: m(NaOH) = М(NaOH)·ν(NaOH) = 40·0,5 = 20 грамм,
η(NaOH) = [m(NaOH) · 100%] : m(раствора) ⇒ масса раствора равна:
m(раствора) = [m(NaOH) · 100%] : η(NaOH) = 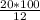 = 166,7 г
= 166,7 г
ответ: масса раствора равна 166,7 грамм
Масса хрома в исходной смеси равна 13 г.
Объяснение:
Дано:
m(смеси)=24 г;
m(раствора)=500 г;
w(соли)=5.04 %;
Найти:
m(Cr)-?
Хлорирование хрома при высокой температуре протекает по реакции:
3Cl2+2Cr=2CrCl3-Хорошо растворяется в холодной воде(но чрезвычайно медленно, растворение ускоряется в присутствии CrCl2)
Хлорирование марганца:
Mn+Cl2=MnCl2-растворим в воде;
Оба соединения растворимы в воде, но растворимость хлорида хрома(|||) протекает чрезвычайно медленно(поэтому вначале он будет в осадке).
w(MnCl2)=m(MnCl2)/m(раствора)
m(MnCl2)=5.04*500/100=25.2 г;
n(MnCl2)=m(MnCl2)/M(MnCl2)=25.2/126=0.2 моль;
n(MnCl2)=n(Mn);
m(Mn)=0.2*55=11 г;
m(Cr)=m(смеси)-m(Mn)=24-11=13 г;
2СН3СН3С4Н8 + 19О2=12СО2 + 14Н2О