CH3C(CH2CH3)=CHCH3
Объяснение:
см. фото
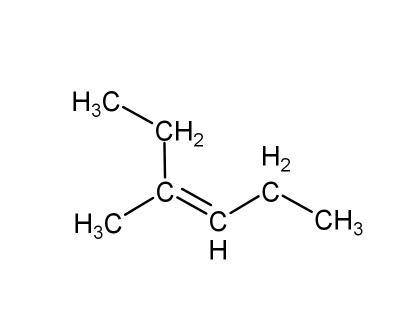
Объяснение:
Обозначим m(Na2SO4) = m. Тогда масса нового раствора будет 53 + m, а масса сульфата натрия в нем 53×0,07 + m. Отношение массы сульфата натрия к массе полученного раствора должно составить 10%/100% = 0,1. Составляем уравнение: 0,1 = (53×0,07 + m)/(53 + m), решая которое, получаем m = 1,77 г.
2. Масса безводного сульфата натрия в 100 г 10 % раствора по определению составляет 10 г. Найдем массовую долю ω(Na2SO4) в кристаллогидрате: ω = Mr(Na2SO4)/Mr(Na2SO4×10H2O) = 0,44, т.е. в 1 г Глауберовой соли содержится 0,44 г Na2SO4. Нужные нам 10 г будут содержаться в 10/0,44 = 22,7 г Глауберовой соли. Таким образом, для приготовления нужного нам раствора следует взять 22,7 г (Na2SO4×10H2O) и 100-22,7 = 77,3 г воды.
3. Обозначим m(Na2SO4×10H2O) = x. Тогда масса нового раствора будет 53 + x, а масса сульфата натрия в нем 53×0,07 + x×ω, где ω = 0,44 (см. п.2). По условию задачи имеем уравнение: 0,1 = (53×0,07+0,44x)/(53 + x), решая которое, получаем x = 4,67 г.
4. При сплавлении с углем Глауберова соль окисляет его до угарного или углекислого газа, восстанавливаясь до сульфита либо сульфида натрия (в зависимости от условий):
Na2SO4 + C → Na2SO3 + CO и т. д.
ответ: 5 моль
2) n(CO2) = 4,48 / 22,4 = 0,2 моль
ответ: 0,2 моль
3) n(SO2) = 9,6 / 64 = 0,15 моль
V(SO2) = 0,15 x 22,4 = 3.36 л
ответ: 3,36л
4) V(Cl2) = (248,5 / 71) x 22,4 = 78,4 л
ответ: 78,4 л
5) V (CH4) = (4 000 / 16) x 22,4 = 5600 л
ответ: 5600 л