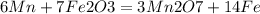
ответ:Рассмотрим процессы, протекающие при электролизе, на примере хлорида натрия. При сильном нагревании твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы натрия и хлора, освободившиеся из кристаллической решетки, и поэтому проводит электрический ток. Если в расплав опустить угольные электроды, присоединенные к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду – катоду, анионы – к положительно заряженному электроду – аноду.
На катоде ионы получают электроны и восстанавливаются до металла:
(восстановление),
а на аноде ионы отдают электроны и окисляются до свободного хлора:
(окисление).
Таким образом, в результате процесса электролиза расплав хлорида натрия разлагается на вещества:
Суммарное уравнение электролиза:
эл.ток
Электролиз отличается от обычных окислительно-восстановительных реакций. При электролизе полуреакции разделены в восстановление происходит только на катоде, а окисление – на противоположном электроде - аноде.
Окислительное и восстановительное действие электрического тока намного сильнее действия обычных химических веществ. Только с тока ученым удалось получить наиболее активные вещества – натрий, калий и фтор. Пионером в использовании электрического тока в химии был английский ученый Гемфри Дэви. Подвергая электролизу расплавы различных соединений, он открыл восемь неизвестных до него химических элементов.
Электролиз растворов электролитов
В водных растворах процессы электролиза осложняются присутствием воды, которая проявляет двойственную природу: она может проявлять свойства и окислителя, и восстановителя. На катоде вода может принимать электроны, и тогда атомы водорода в ней будут восстанавливаются до газообразного водорода:
.
На аноде вода может отдавать электроны, при этом атомы кислорода будут окисляться до газообразного кислорода:
.
Другими словами, при электролизе растворов электролитов (чаще всего солей) на катоде и аноде протекают конкурирующие процессы: катионы металла конкурируют с катионами водорода , а анионы кислотных остатков конкурируют с анионами гидроксильных групп . Рассмотрим подробнее процессы, протекающие на электродах.
ЗАКОНОМЕРНОСТИ ПРОЦЕССОВ НА КАТОДЕ
На отрицательно заряженном электроде - катоде, происходит восстановление катионов, которое не зависит от материала катода, из которого он сделан, но зависит от активности металла, т.е. от положения металла в электрохимическом ряду напряжения (ЭХР). (Сравниваем окислительную то есть принимать электроны, ионов металлов и иона водорода)
Объяснение: