Задача 1.
х г у г 22 г
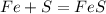
56 г 32 г 88 г
1. При взаимодействии 56 г железа образуется 88 г сульфида, а
при --//--//--//-- х г__________________22 г, откуда
х=56*22/88=14 г
2. При взаимодействии 32 г серы образуется 88 г сульфида, а
при --//--//--//-- у г________________22 г, откуда
у=32*22/88=8 г
Задача 2.
13 г х г у г
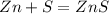
65 г 32 г 97 г
1. Для полного взаимодействия 65 г цинка необходимо 32 г серы, а
для --//--//--//--//--//-- 13 г_________________х г, откуда
х=13*32/65=6,4 г
2. При взаимодействии 65 г цинка образуется 97 г сульфида, а
при --//--//--//--//-- 13 г________________у г, откуда
у=97*13/65=19,4 г
1)Реакция на избыток и недостаток,т.е. надо найти какое вещество было взято в недостатке и по нему решить через уравнение реакции задачу.
n=m/M
n(NH4Cl)=10,7г/53,5г/моль=0,2 моль
n(Ca(OH)2)=6г/74г/моль=0,08 моль
2)Пишем уравнение реакции:
6г x г
NH4Cl+Ca(OH)2===> 2NH3+CaCl2+2H2O(реакция происходит при 200 гр. по Цельсию)
M=74г/моль 17г/моль
m=74 г 34 г
Следовательно х=6г*34г/74 г=2,8 г
3)Объем узнаем по формуле:
n=V/Vm => V=n*Vm
n(NH3)=m/M=2,8г/17г/моль=0,16 моль
V=0,16 моль*22,4 л/моль=3,584 л
ответ: газ-NH3, масса=5,1 г,объем=3,584 л
[Cr(H2O)6]³⁺