1) 3 атома водорода, 4 атома алюминия, 8 атомов магния, 1 молекула водорода, 1 молекула кислорода, 3 атома кислорода, 5 молекул метана, 4 молекулы углекислого газа, 1 молекула воды, 3 молекулы воды, 2 молекулы водорода, 3 атома азота, 4 молекулы азота
2) 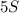 (5 атомов серы),
(5 атомов серы), 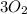 (3 молекулы кислорода),
(3 молекулы кислорода),  (4 атома меди),
(4 атома меди), 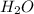 (1 молекула воды),
(1 молекула воды), 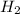 (2 атома водорода),
(2 атома водорода),  (1 молекула углекислого газа ), CO (молекула угарного газа),
(1 молекула углекислого газа ), CO (молекула угарного газа), 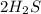 ( 2 молекулы сероводорода),
( 2 молекулы сероводорода), 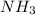 (молекула аммиака)
(молекула аммиака)
3) 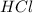 атом водорода и атом хлора
атом водорода и атом хлора
Mr (HCL) = Ar(H) + Ar (Cl) = 1 + 35, 5 = 36,5
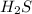 два атома водорода и атом серы
два атома водорода и атом серы
Mr (H2S) = Ar(H) × 2 + Ar (S) = 2 + 32 = 34
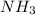 атом азота и три атома водорода
атом азота и три атома водорода
Mr (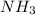 ) = Ar(N) + Ar (H) × 3 = 14 + 3 = 17
) = Ar(N) + Ar (H) × 3 = 14 + 3 = 17
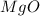 атом магния и атом кислорода
атом магния и атом кислорода
Mr (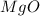 ) = Ar(Mg) + Ar (O) = 24 + 16 = 40
) = Ar(Mg) + Ar (O) = 24 + 16 = 40
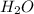 два атома водорода и атом кислорода
два атома водорода и атом кислорода
Mr (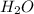 ) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
 атом углерода и два атома кислорода
атом углерода и два атома кислорода
Mr ( ) = Ar(C) + Ar (O) × 2 = 12 + 32 = 44
) = Ar(C) + Ar (O) × 2 = 12 + 32 = 44
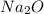 два атома натрия и атом кислорода
два атома натрия и атом кислорода
Mr (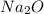 ) = Ar(Na) × 2 + Ar (O) = 46 + 16 = 62
) = Ar(Na) × 2 + Ar (O) = 46 + 16 = 62
 атом серы и два атома кислорода
атом серы и два атома кислорода
Mr ( ) = Ar(S) + Ar (O) × 2 = 32 + 32 = 64
) = Ar(S) + Ar (O) × 2 = 32 + 32 = 64
4) 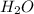 аш–два-о
аш–два-о
Mr (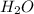 ) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
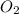 о-два
о-два
Mr (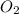 ) = Ar(O) × 2 = 32
) = Ar(O) × 2 = 32
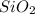 силициум–о–два
силициум–о–два
Mr (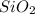 ) = Ar(Si) + Ar (O) × 2 = 28 + 32 = 60
) = Ar(Si) + Ar (O) × 2 = 28 + 32 = 60
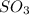 эс–о–три
эс–о–три
Mr (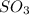 ) = Ar(S) + Ar (O) × 3 = 32 + 48 = 80
) = Ar(S) + Ar (O) × 3 = 32 + 48 = 80
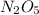 эн–два–о–пять
эн–два–о–пять
Mr (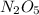 ) = Ar(N) × 2 + Ar (O) × 5 = 28 + 80 = 108
) = Ar(N) × 2 + Ar (O) × 5 = 28 + 80 = 108
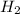 аш-два
аш-два
Mr (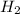 ) = Ar(H) × 2 = 2
) = Ar(H) × 2 = 2
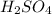 аш-два-эс-о-четыре
аш-два-эс-о-четыре
Mr (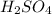 ) = Ar(H) × 2 + Ar (S) + Ar(O) × 4 = 2 + 32 + 64 = 98
) = Ar(H) × 2 + Ar (S) + Ar(O) × 4 = 2 + 32 + 64 = 98
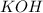 калий-о-аш
калий-о-аш
Mr (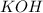 ) = Ar(K) + Ar (O) + Ar(H) = 39 + 16 + 1 = 56
) = Ar(K) + Ar (O) + Ar(H) = 39 + 16 + 1 = 56
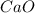 кальций-о
кальций-о
Mr (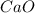 ) = Ar(Ca) + Ar (O) = 40 + 16 = 56
) = Ar(Ca) + Ar (O) = 40 + 16 = 56
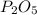 пэ-два-о-пять
пэ-два-о-пять
Mr (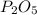 ) = Ar(P) × 2 + Ar (O) × 5 = 62 + 80 = 142
) = Ar(P) × 2 + Ar (O) × 5 = 62 + 80 = 142
кислотный дождь-это оксиды серы и оксиды азота
мрамор карбонат кальция
карбонат кальция вступает в реакцию с оксидами и разрушается
Объяснение:
Оксиды серы(IV) и азота (IV) - кислотные, при взаимодействии с водой могут образовывать кислоты, а также вытеснять более летучие оксиды из их солей.
1) С SO₂ идут различные реакции:
CaCO₃ + SO₂ = CaSO₃ + CO₂ ↑
CaSO₃ + SO₂ + H₂O = Ca(HSO₃)₂
Образующийся гидросульфит кальция (Са(HSO₃)₂) растворим в воде, он смывается дождем, выделяющийся углекислый газ этому.
2CaCO₃ + 2SO₂ + O₂ = 2CaSO₄ + 2CO₂↑
Сульфит и сульфат кальция, поглощая влагу, превращаются в соответствующие кристаллогидраты. Это приводит к увеличению их объема и механическому разрушению статуй.
2) Двуокись азота, взаимодействуя со влагой,образует азотную и азотистую кислоты, разрушающие мрамор.
2NO₂ + H₂O = HNO₃ + HNO₂
СаСO₃ + 2HNO₃ = Ca(NO₃)₂ + H₂O + CO₂↑
CaCO₃ + HNO₂ = Ca(NO₂)₂ + CO₂↑ + H₂O
Возможно протекание ОВР
CaCO₃ + 3NO₂ = Ca(NO₃)₂ + NO↑ + CO₂↑
Нитриты и нитраты хорошо растворимы.
3) Углекислый газ, как атмосферный, так и образующийся при взаимодействии с оксидам серы(IV) и азота (IV) также оказывает пагубное влияние:
CaCO₃ + СО₂ +Н₂О = Са(НСО₃)₂
В отличие от карбоната кальция (мела и мрамора) образующийся гидрокарбонат кальция растворим, статуя постепенно разрушается, продукт реакции смывается дождем.
Т.о. нахождение мраморных скульптур на открытом воздухе неизбежно приводит к их изъязвлению и разрушению
CaCO3 -->CaO + CO2↑
100 г 56 г
Найдём массу веществ по уравнению:
m = M x n
m(CaCO3) = 100 г/моль х 1 моль = 100 г
m(CaO) = 56 г/моль х 1 моль = 56 г
Если массовая доля мела указана, решаем так:
Найдем массу мела в смеси:
ω = m(в-ва) x 100% / m(смеси)
m(в-ва) = ω х m(смеси) / 100%
1) m(CaCO3) = 20% х 250 г / 100% = 50 г
Если 20% это примеси то так:
ω(СaCO3) = 100% - 20% = 80 %
2) m(CaCO3) = 80% х 250 г / 100% = 200 г
Найдем массу оксида:
1) m(CaO) = 50 г х 56 г / 100 г = 28 г
2) m(CaO) = 200 г х 56 г / 100 г = 112 г