ответ: (Извини за задержку ^_^)
n = 10802
V р-ра = 17.74 ml
Объяснение:
В xоде решения x - это кол-во вещества (ню)
Дано:
Mr ( [C6H10O5]n) = 1 750 000
р (р-ра HNO3) = 1.3 g/ml
w (HNO3) = 50%
m( [C6H5O3(ONO2)3]n = 20г
Составим уравнение на основе молекулярной массы:
1 750 000 = Mr(C6H10O5) * n
1 750 000 = 162 * n
n = (примерно) 10802
Найдём моль тринитроклетчатки:
M( [C6H5O3(ONO2)3]n) = 311 g/mol * 10802 = 3 539 422 g/mol
x( [C6H5O3(ONO2)3]n) = 20g / 3 539 422 g/mol = 0.00000565 mol
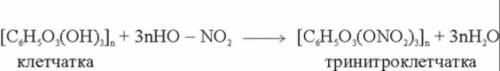
По уравнению на картинке, видим, что требуется в 3n раз больше моль HNO3, чем моль тринитроклетчатки. Следовательно:
x (HNO3) = 3 * 10802 * 0.00000565 = 0.183 mol
m (HNO3) = 0.183 mol * 63g/mol = 11.529g
m р-ра = m (HNO3) / w (HNO3) = 11.529g / 0.5 = 23.058g
V р-ра = 23,058g / 1.3g/ml = 17.74 ml
Гидроксид меди(II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество. Кристаллы образуют решётку ромбической сингонии, параметры ячейки a = 0,2949 нм, b = 1,059 нм, c = 0,5256 нм, Z = 4. Cu(ОН)2 практически не растворим в воде.При нагревании до 70—90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и Н2О.
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
Cu(OH)2+H2SO4 CuSO4+2H2O
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты(II): Cu(OH)2+2NaOH Na2Cu(OH)4.
Медь (II) , гидроксид представляет собой гидроксид из меди с химической формулой из Cu (OH) 2 . Это бледно - зеленовато - голубой или голубовато - зеленая твердое вещество.
2. Б
3. В
4. А
5. А
6. В
7. 14 литров должно быть из реакции сгорания, нет такого ответа
8. А
9. Б
10. А
11. 1-Б ; 2-А; 3-В; 4-Д
12.
1) CaC2 + 2H2O = Ca(OH)2 + C2H2
2) C2H2 + H2O =Hg2+=CH3COH
3) CH3COH + H2 = CH3CH2OH
13. 3) - реакция гидрирования
14.
а) CH2=CH-CH2-CH3 (бутен-1)
б) CH3-CH=CH-CH2-CH3 (пентен-2)
15. спирты, содержащие одну гидроксогруппу ОН