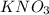 . Здесь щелочной металл и кислотный остаток сильной соли Здесь гидролиз и по катиону и по аниону будет слабый.
. Здесь щелочной металл и кислотный остаток сильной соли Здесь гидролиз и по катиону и по аниону будет слабый.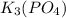 - здесь ортофосфорная кислота - кислота средней силы. Здесь гидролиз по аниону посильнее, чем в предыдущем случае.
- здесь ортофосфорная кислота - кислота средней силы. Здесь гидролиз по аниону посильнее, чем в предыдущем случае.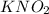 - наибольший из всех гидролиз. Так как соль азотистой кислоты. Эта кислота слабее ортофосфорной. Поэтому гидролиз по аниону протекает лучше, чем во втором случае.
- наибольший из всех гидролиз. Так как соль азотистой кислоты. Эта кислота слабее ортофосфорной. Поэтому гидролиз по аниону протекает лучше, чем во втором случае.