1. При прибавлении к раствору цитрата избытка известковой воды на холоду осадка не образуется. При нагревании же выпадает хлопьевидный осадок цитрата калия, при охлаждении (в закрытой колбе) вновь растворяющийся.
2. Нагревают 5 мл 1%-ного раствора лимонной кислоты с 1 мл реактива Дениже (5 г окиси ртути растворяют в смеси 20 мл концентрированной серной кислоты и 100 мл воды при нагревании до кипения) и прибавляют несколько капель 2%-ного раствора пер-манганата калия. Жидкость обесцвечивается и выпадает белый кристаллический осадок:
Промытый осадок растворяется в растворе хлорида натрия с образованием хлорида ртути и ацетон-дикарбоновой кислоты, которая с хлоридом железа дает малиново-красное окрашивание. 3. Реакция образования пентабромацетона
К водному раствору лимонной кислоты или цитрата в очень разбавленной серной или азотной кислоте (но не соляной) прибавляют
2-5 капель 0,1 н. раствора перманганата калия и нагревают в течение непродолжительного времени до 30-40° (только не кипятить!). Как только раствор побуреет или помутнеет от незначительного выделения двуокиси марганца, прибавляют 1-2 капли раствора ок-салата аммония и 1 мл 10%-ной серной кислоты, при этом жидкость становится прозрачной. Затем прибавляют несколько капель бромной воды. При этом выделяется кристаллический осадок пента-бромацетона.1
4.Глюкоза даёт синее окрашивание с свежеприготовленным Сu(OH)2. Даёт реакцию серебрянного зеркала с Ag(NH3)2OH/
2.Li - 3 протона, 4 нейтрона (от относительной молекулярной массы вычитаем порядков оё число, 7-3=4), 3 электрона. Заряд ядра (число протонов) - +3
Ca - 20 - протонов, нейтронов, электронов. Заряд ядра - +20
P - 15 - протонов и электронов, 16 - нейтронов. Заряд ядра - +15.
Al - 13 - протонов и электронов, 14 - нейтронов. Заряд ядра - +13.
3. Если в 44 г СО2 содержится 1 моль вещества, то в 200 г - х.
Составим пропорцию:
44 г - - 1 моль
200 г - - х моль
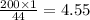
ответ: Приблизительно 4,55 мола.
4.
22,4 л = 1 моль = 6.02×10²³=Mr(относительная молекулярная масса вещества).
22,4 л P2O5 = 1 моль
1 моль = 142 г Р2О5.
ответ:142 г.
Сейчас напишу продолжение.
Аллотропия - существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам.
Например, кислород О2 (бесцветный, без вкуса и запаха, растворим в воде, поддерживает дыхание), озон O3 (голубого цвета, имеет запах, ядовит, тяжелее воздуха)
Различия - во внутреннем строении, длина связи между атомами разная, расположение атомов относительно друг друга.