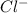12 3 cr--> crcl3--> cr(oh)3--> nacro2 4 l cr2o3 дайте характеристику реакции 4 с точки зрения различных классификаций. выберите окислительно-восстановительный процесс, назовите окислитель и восстановитель. уравнение одной из реакций обмена напишите в молекулярной и краткой ионной формах. назовите исходные вещества и продукты этой реакции


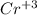 +3
+3 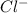 +3
+3 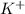 +3
+3 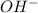 =Cr(OH)3+ 3
=Cr(OH)3+ 3 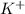 +3
+3