Дано:
m (CₙH₂ₙ₊₁Cl) = 12,9 г.
m (CₙH₂ₙ₊₁Br) = 21,8 г.
Найти:
CₙH₂ₙ
(1) CₙH₂ₙ + HCl ===> CₙH₂ₙ₊₁Cl
(2) CₙH₂ₙ + HBr ===> CₙH₂ₙ₊₁Br
• По уравнению 1 реакции:
ν (CₙH₂ₙ) : ν (HCl) : ν (CₙH₂ₙ₊₁Cl) = 1 : 1 : 1
• Найдём молярную массу хлоралкана:
M (CₙH₂ₙ₊₁Cl) = Mr (CₙH₂ₙ₊₁Cl)
Mr (CₙH₂ₙ₊₁Cl) = 12n + 2n + 1 + 35,5 = 14n + 36,5
M (CₙH₂ₙ₊₁Cl) = 14n + 36,5
• Найдём количество хлоралкана:
ν (CₙH₂ₙ₊₁Cl) = m/M = 12,9 г./(14n + 36,5)
• По уравнению 2 реакции:
ν (CₙH₂ₙ) : ν (HBr) : ν (CₙH₂ₙ₊₁Br) = 1 : 1 : 1
• Найдём молярную массу бромалкана:
M (CₙH₂ₙ₊₁Br) = Mr (CₙH₂ₙ₊₁Br)
Mr (CₙH₂ₙ₊₁Br) = 12n + 2n + 1 + 80 = 14n + 81
M (CₙH₂ₙ₊₁Br) = 14n + 81
• Найдём количество бромалакна:
ν (CₙH₂ₙ₊₁Br) = m/M = 21,8 г./(14n + 81)
• Заметим, что ν (CₙH₂ₙ₊₁Cl) = ν (CₙH₂ₙ₊₁Br), ⇒
12,9/(14n + 36,5) = 21,8/(14n + 81)
12,9(14n + 81) = 21,8(14n + 36,5)
180,6n + 1044,9 = 305,2n + 795,7
-124,6n = -249,2
n = 2
C₂H₄ - этен/этилен
Структурная формула:
H₂C=CH₂
ответ: H₂C=CH₂ (этилен)
Объяснение:
Пишем кинетическое уравнение для прямой реакции до увеличения объема
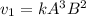
Пишем кинетическое уравнение для обратной реакции до увеличения объема
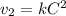
Пишем кинетическое уравнение для прямой реакции после увеличения объема (если объем увеличился в 2 раза, то концентрации веществ уменьшились во столько же)
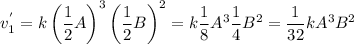
Пишем кинетическое уравнение для обратной реакции после увеличения объема (если объем увеличился в 2 раза, то концентрации веществ уменьшились во столько же)
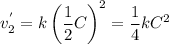
Считаем во сколько раз уменьшится скорость прямой реакции
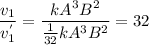
Считаем во сколько раз уменьшится скорость обратной реакции
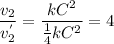
Делаем вывод: если прямая реакция замедлилася в 32 раза, а обратная только в 4, то равновесие сместится влево (в сторону исходных веществ). Это согласуется и с принципом Ле Шателье.
Cooh - карбоновые кислоты