1.найти массовую долю выхода сульфида алюминия, если в реакцию с серой (избыток) вступает алюминий массой 27 г и образуется сульфид алюминия массой 75 г. 2. уравнение горения метана: сн4 + 202= с02 + 2н20 + 804 кдж. рассчитать, сколько теплоты выделится при сжигании метана объемом 10 м3 (н. 3. рассчитать массу хлорида железа (ш), которая образуется при взаимодействии железа с хлором объемом 33,6 дм3 (н. 24. определить с качественных реакций каждое из двух предложенных органических веществ: глюкоза, уксусный альдегид.

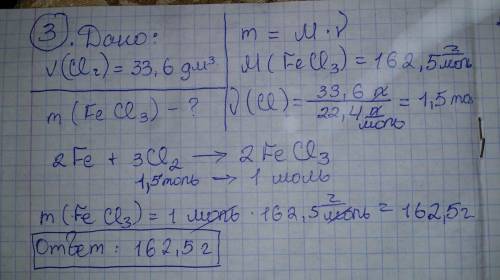

27 г х г
2Al + 3S --> Al2S3
2*27 27*2+32*3
х= 27*(27*2+32*3)/(2*27)= 75 г
выход=75/75=1; 100%
2. Термохимическое уравнение горения метана:
10 м^3 х кДж
СН4 + 2О2= СО2 + 2Н2О + 804 кДж.
0.0224 м^3
х= 10*804/0,0224= 358929 кДж
3.
33,6 л х г
2Fe + 3Cl2 --> 2FeCl3
3*22,4 2*(56+3*35,5)
х=33,6*2*(56+3*35,5)/(3*22,4)= 162,5 г
4. реактив на глюкозу - гидроксид меди (II) - ярко синее окрашивание (как многоатомый спирт), а если нагреть, то окраска изменится на желтую, а потом на красную (как альдегид)
реактив на уксусный альдегид - гидроксид меди (II) при нагревании - сначала желтое, а потом красное окрашивание