грамм-молекулярная масса ca(no3)2*4h2o составляет 236 г. на долю ca(no3)2 приходится 164 г., на долю 4 молей воды – 72 г.
найдем количества молей ca(no3)2 и ca(no3)2*4h2o:
n(ca(no3)2) = n(ca(no3)2*4h2o) = 61,5/164 = 0,375 моль.
найдем массу 0,375 моль ca(no3)2*4h2o:
m(ca(no3)2*4h2o) = 0,375 *236 = 88,5 г.
масса «чистой» воды без учета кристаллизационной составляет: 111,5 — 88,5 = 23 г.
теперь найдем растворимость кристаллогидрата ca(no3)2*4h2o, для чего составим пропорцию:
23 г. воды растворяют 88,5 г. ca(no3)2*4h2o
100 г. » » х г. »
х = 100 ⃰ 88,5/23 = 384,7826 г.
ответ: 384,7826.
0,02 л,х л 90 г у г
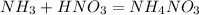
22,4 л 63 г 80 г
1. Сначала определим чистую массу кислоты в растворе:
m(HNO3)=m(раствора)*w(HNO3)=600*0,15=90 г
2. Подставив эту массу в уравнение и приняв объем аммиака за Х,найдем,какое из исходных веществ прореагирует полностью (без остатка):
для полного взаимодействия 22,4 л аммиака необходимо 63 г кислоты, а
для -- // -- х л_______________________90 г, откуда
х=22,4*90/63=32 л
3. Как видим,что кислота дана в избытке,поэтому расчет массы соли ведем по объему аммиака:
при взаимодействии 22,4 л аммиака получится 80 г соли, а
при -- // -- 0,02 л__________________у г, откуда
у=0,02*80/22,4=0,07 г