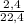 = 0,107 моль
= 0,107 моль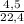 = 0,2 моль
= 0,2 моль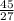 ≈ 1,7 моль
≈ 1,7 моль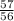 = 1,017 моль
= 1,017 моль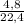 = 0,2 моль
= 0,2 моль1) Некорректная, на мой взгляд, формулировка вопроса. Надо или записать уравнение реакции, либо четко указать, о каком именно тепловом эффекте идет речь (на 1 моль бензола или на 2 моль). Для ответа выбран вариант сгорания 1 моль бензола.
Термохимическое уравнение реакции сгорания 1 моль бензола:
C6H6(ж) + 7,5 O2(г) = 6 CO2(г) + 3 H2O(пар), ΔH= -3 135,58 кДж/моль
Одно из следствий закона Гесса - тепловой эффект реакции ΔH можно рассчитать как разность теплот образования ΔHf продуктов и реагентов (с учетом стехиометрических коэффициентов):
ΔH = ∑ΔHf(продукты) - ∑ΔHf(реагенты)
В нашем случае:
ΔH = 6*ΔHf(CO2(г)) + 3*ΔHf(H2O(пар)) - ΔHf (C6H6(ж)) - 7,5*ΔHf (O2(г))
Теплота образования ΔHf - это тепловой эффект реакции образования одного моль вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Теплота образования простых веществ принимается равной нулю.
Поэтому 7,5*ΔHf (O2(г)) = 7,5*0 = 0.
По справочным данным:
теплота образования CO2 ΔHf (CO2(г)) = -393,51 кДж/моль
теплота образования H2O ΔHf (H2O(ж)) = -285,83 кДж/моль
теплота парообразования H2O ΔHкип (H2O) = 44,0 кДж/моль
Последняя величина нужна, потому что продукт реакции не стандартная жидкая вода, а ее пар. Знак + означает, что теплота не выделяется, а наоборот, поглощается водой при парообразовании.
Теплота образования водяного пара равна:
ΔHf (H2O(пар)) = ΔHf (H2O(ж)) + ΔHкип (H2O) = -285,83+44,0 =
= -241,83 кДж/моль.
Подставляем справочные данные в уравнение теплового эффекта реакции:
-3 135,58 = 6*(-393,51) + 3*(-245,17) - ΔHf (C6H6(ж))
-3 135,58 = -2 361,06 - 735,51 - ΔHf (C6H6(ж))
-3 135,58 = -3 096,57 - ΔHf (C6H6(ж))
-39,01 = - ΔHf (C6H6(ж))
ΔHf (C6H6(ж)) = 39,01 кДж/моль
2)
Эквивалентная концентрация в случае соли равна молярной концентрации, умноженной на валентность металла и на числе его атомов в молекуле соли.
Сэ=См*(2*1) = 2*См = 2*2 моль/л = 4 моль/л
Сэ = 4 моль/л эквивалентов
Для расчета массовой доли возьмем 1 литр раствора.
Его масса равна произведению объема на плотность: 1,14 г/мл*100 мл = 1140 г
Масса же растворенного сульфата меди равна его молярной массе, умноженной на его количество вещества. Количество вещества n численно равно молярной концентрации: n=2 моль (поскольку взят ровно 1 литр раствора)
Молярная масса сульфата меди равна 160 г/моль.
Отсюда масса вещества равна 2 моль * 160 г/моль = 320 г
Массовая доля равна 320 г/ 1 140 г = 0,28 = 28%
Массовая доля сульфата меди 28%
1) z x y
HgCl2 + Cu = CuCl2 + Hg
272 64 201
y = 201z/272
x = 64z/272
Медь с пластинки ушла в количестве х грамм, а ртуть появилась в количестве у грамм. То есть у - х = 52,72 - 50 = 2,72
Получим уравнение: z((201/272)- (64/272)) = 2,72
137z/272 = 2,72
z = 2,72*272/137 = 5,44 г HgCl2.
2) 4,2 x y
CuSO4 + Fe = FeSO4 + Cu
160 56 64
50*0,15*1,12 = 8,4 г сульфата меди. Вступило в реакцию - 4,2 г.
С пластинки ушло железа:
х = 4,2*56/160 = 1,47 г.
На пластинку осела медь:
у = 4,2*64/160 = 1,68 г.
Масса пластинки стала: 50 + 1,68 - 1,47 = 50,21
ответ: 50,21 г.
3) x 1 г у z
CuSO4 + Fe = FeSO4 + Cu
160 56 152 64
За исходное я принял, что 10% железа прореагировало, то есть 1 г. Может это неправильное предположение.
Найдем остальные компоненты:
х = 160/56 = 2,86 г
у = 152/56 = 2,71 г
z = 64/56 = 1,14 г.
Итак 1 г железа ушел с пластины в раствор, а 1,14 г меди осели на пластине. Масса пластины стала: 10 -1 + 1,14 = 10,14 г.
Из раствора ушло 2,86 г сульфата меди. Осталось 200*0,2 - 2,86 = 37,14 г.Первоначальное количество воды не изменилось - 160 г. Еще образовался сульфат железа (II) - 2,71 г также поступившие в раствор.
Суммарная масса раствора: 37,14 + 160 + 2,71 = 199,85 г.
Процентное содержание сульфата меди: 37,14*100%/199,85 = 18,58%.
ответ: 10,14 г. 18,58%.