Объяснение:
Вода или раствор в колбе, кристаллы вещества, смесь порошков, содержимое аэрозольного , батон хлеба, огурец — все эти объекты можно рассматривать в качестве систем. В химии не считают системами отдельные частицы вещества, так как они не подчиняются законам и правилам химии, которые всегда относятся к объектам, состоящим из большого числа структурных единиц.
В химии различают гомогенные и гетерогенные системы. В любой части гомогенной системы состав и свойства одинаковы. В гетерогенной системе имеются части (фазы) с разным составом и (или) свойствами.Однородность растворов является результатом дробления растворенных веществ до отдельных структурных единиц (молекул, атомов, ионов). Только такие системы относят к истинным растворам. Если какие-либо вещества раздроблены или размолоты до песчинок, порошка, мелких капелек и распределены в жидкости, то это коллоидный раствор (суспензия, эмульсия) — не настоящий раствор, так как такие системы негомогенны. Они тоже имеют разнообразное практическое применение. Смесь цемента, песка и воды в строительном деле называют раствором. Но с точки зрения химии эта кашица не раствор, а суспензия.
В жидких растворах химические реакции протекают в объеме, поэтому все имеющееся вещество доступно для химического превращения без дополнительного воздействия на систему. Частицы веществ довольно свободно двигаются, сталкиваются и достаточно быстро подвергаются химическому превращению. Для сравнения представим себе, как идет химическая реакция в смеси твердых веществ. Их частицы закреплены в кристаллической структуре. Кристаллы соприкасаются в отдельных точках, в которых только и возможно взаимодействие частиц. Частицы, находящиеся в объеме кристалла (не на поверхности), участвовать в реакции не могут. Для ускорения реакции кристаллы перетирают в ступке, прессуют, но и при этом полнота протекания реакции достигается далеко не сразу. Некоторые лекарства выпускают в виде больших таблеток. Такая таблетка в стакане с водой начинает выделять газ. Очевидно, что твердые вещества в таблетке не реагировали между собой, а растворяясь, начали реагировать.Бывает и так, что твердые вещества реагируют со взрывом. Выделение энергии, начавшееся в результате превращения отдельных частиц, расшатывает структуру вещества и реакция лавинообразно ускоряется. Такие неприятности редко происходят в растворах, особенно в водных. Выделяющаяся энергия аккумулируется большой массой растворителя, и опасного разогревания системы не происходит.Таким образом, растворы чрезвычайно важны как среда для проведения химических реакций. Можно также сказать, что растворы по своей природе подвижны. Именно такие системы пригодны в качестве внутренней среды живых организмов, так как жизнедеятельность основана на постоянном осуществлении множества химических превращений.
2) Растворы имеют собственные физические свойства, отличные от свойств индивидуальных веществ. Вода замерзает при температуре О °С, увеличивая свой объем. На морозе ее нельзя применять для охлаждения автомобильного двигателя. Вместо воды используют антифриз — водный раствор этиленглиголя НОСН2СН2ОН, замерзающий при температуре -40 °С, а при повышенном содержании этиленгликоля — даже при -65 °С. Металлические сплавы также дают множество примеров изменения свойств растворов (сплавы — это твердые растворы) по сравнению с индивидуальными металлами.
3)Применяя вещество в растворенном виде, можно изменять силу его действия или активность. В домашних условиях нередко для лечения применяют раствор перманганата калия (марганцовки) КМп04. Ярко-розовый раствор можно использовать только наружно, а бледно- розовый, т. е. более разбавленный раствор, не опасен и для промывания желудка. Темно-фиолетовые растворы перманганата калия в медицинских целях не используют, так как они вызывают сильные ожоги слизистых оболочек и кожи. Очевидно, что окраска, а также сила воздействия перманганата калия зависят от концентрации приготовленного раствора. Точно так же и в других случаях применение вещества в растворе позволяет контролировать его действие с целью получения наибольшего полезного эффекта и снижения токсического или разрушающего результата. Это делает растворы особенно ценными для использования как в прикладных областях, так и в самой химии.
Следует обратить внимание, что перечисленные положения, характеризующие свойства растворов, относятся главным образом к жидким растворам, и лишь второй пункт и отчасти третий — к твердым растворам.
15.1
Al2(SO4)3 - сульфат аллюминия
Ba(NO3)2 - нитрат бария
NaAlO2 - метаалюминат натрия
K2CO3 - карбонат калия
FeCl3 - хлорид железа (III)
Na3AsO4 - арсенат натрия
AgI - йодид серебра
Na2SiO3 - силикат натрия
15.2
HNO2 - соотетствующим оксидом будет N2O3
Be(OH)2 - соотетствующим оксидом будет BeO
HIO3 - соотетствующим оксидом будет Cl2O5
H2CrO4 - соотетствующим оксидом будет CrO3
Cr(OH)3 - соотетствующим оксидом будет Cr2O5
15.3
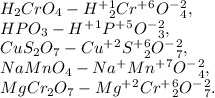
15.4
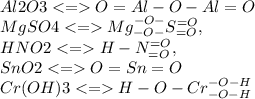
15.5
ZnSO4 → Zn(OH)2 → ZnCl2 → AlCl3 → Al(OH)3.
ZnSO4 +NaOH = Na2SO4 + Zn(OH)2;
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O;
3ZnCl2 + 2Al = 2AlCl3 + 3Zn;
AlCl3 + 3NaOH = 3NaCl + Al(OH)3
4P + 5O2 = 2P2O5
Молярная масса фосфора - 31г/моль, значит n(P) = 6,2/31 = 0,2 моль
Значит, n(P2O5) также равно 0,2 моль. Молярная масса оксида фосфора - 142 г/моль, значит m(P2O5)= 0,2 х 142= 28,4г.
ответ: 28,4 грамма.