37 г 12,5 л, х л у г
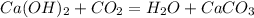
74 г 22,4 г 100 г
1. Визначимо чисту массу гідроксида у розчині:
m(Ca(OH)2)=m(рочину)*w(Ca(OH)2)=50*0,74=37 г
2. Підставивши цю масу до рівняння і прийнявши об'єм вуглекислого газу за Х,визначимо,яка з вихідних речовин прорегує повністю(без залишку):
для повної взаємодії 74 г гідроксида потрібно 22,4 л вуглекислого газу, а
для -- // -- // -- 37 г___________________х л, звідки
х=37*22,4/74=11,2 л
3. Як бачимо,що за умовами вуглекислого газу дано у надлишку,тобто повністю прореагує гідроксид,от за його масою і визначимо масу осаду:
при взаємодії 74 г гідроксиду випадає 100 г осаду, а
при -- // -- 37 г___________________у г, звідки
у=37*100/74=50 г
CaCO3 + 2HCl - > CaCl2 + CO2| + H2O
M=100г/моль 22,4л/моль(н.у.)
W(CaCO3)=80%(0,8)
m(р.в.)=W(80%)*m(р.)
m(CaCO3)=0,8*240=192г
n=m/M
n(CaCO3)=192/100=1,92моль
n(CaCO3) : n(CO2)
1 1 =>
=> n(CO2)=1,92моль
Vm=V/n - > V=Vm*n
V(CO2)=22,4*1,92=43л