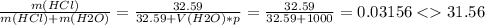 %
%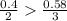 ⇒KClO3 избыток,рассчёт по O2
⇒KClO3 избыток,рассчёт по O2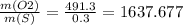 раза больше
раза больше1. В основу своей классификации химических элементов Д. И. Менделеев положил относительную атомную массу.
2. Менделеев формулировал периодический закон так: "Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов".
3. Закон был назван периодическим, поскольку свойства элементов меняются периодично, с заданной периодичностью.
4. 1) Химический знак натрия - Na;
Порядковый номер элемента - 11;
Номер периода - 3;
Номер группы - 1;
Номер подгруппы - главная (А) подгруппа;
3)Формула оксида - Na2O;
4) Характер оксида - основный;
5) Формула гидроксида - NaOH;
6) Характер гидроксида - основание;
7) 1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов:
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2=(под действием температуры) CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 =(под действием температуры)Сa (AlO2)2.
H2 + Cl2 = 2HCl
Составляем пропорцию:
V(H2)/[n(H2)*Vm] = m(HCl)/[n(HCl)*M(HCl)]
Находим массу HCl
m(HCl) = 10*2*36,5/22,4 = 32,59 г
Находим массовую долю кислоты:
w = m(HCl)/[m(HCl) + m(H2O)] = 32.59/(32.59 + 1000) = 0,0316 или 3,16%
ответ: 0,0316 или 3,16%
2. Реакция разложения бертолетовой соли в присутствии оксида марганца:
2KClO3 = 2KCl + 3O2
Аналогично первому случаю находим массу прореагировавшей соли через объем полученного кислорода:
m(KClO3) = 13*2*122,5/(3*22,4) = 47,4 г
Находим долю прореагировавшей соли:
47,4/49 = 0,967 или 96,7%
ответ: 0,967 или 96,7%
3. Выразим массы элементов в земной коре, через их доли:
сера - m(S) = w(S) * m(коры)
кислород - m(O) = w(O) * m(коры)
Выражаем соотношение масс:
m(O)/m(S) = w(O)/w(S) = 49,13/0,03 = 1637,67
ответ: Кислорода в 1637,67 раза больше серы