1)В кристаллических веществах атомы расположены в узлах кристаллической решетки. В аморфных веществах атомы расположены беспорядочно, так же как в жидкостях. Кристаллические вещества имеют строго определенную температуру плавления. Аморфные вещества не имеют строго определенной температуры плавления.
2)
3)Кристаллическиминазывают вещества, в которых частицы располагаются в строгом порядке.
Примеры кристаллических веществ: алмаз, сахар, металлы, соли, щёлочи, большинство оксидов и простых веществ
4)
Твёрдые вещества делят на аморфные и кристаллические.
Отличие аморфных и кристаллических веществ заключается в степени упорядоченности их внутреннего строения.
В кристаллических веществах все частицы располагаются в определённом порядке.
В аморфных веществах этот порядок относительный.
Объяснение:
Твёрдые вещества делят на аморфные и кристаллические.
Отличие аморфных и кристаллических веществ заключается в степени упорядоченности их внутреннего строения.
В кристаллических веществах все частицы располагаются в определённом порядке.
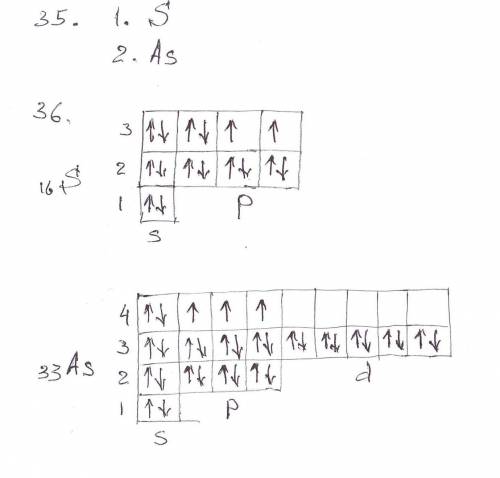
36. Дописать название подуровня и его номер. Записать химический знак элемента и перед ним поставить его порядковый номер. (См. в файл)
37. Номеру данного периода.
38. Номеру группы.
39. Количеством валентных электронов, т.е. электронов на внешнем слое.
40. Изменением строения их электронных оболочек. В каждом периоде происходит заполнение электронами внешнего энергетического уровня до восьми. Следовательно, электронные конфигурации наружных энергетических уровней периодически повторяются.
41. s-элементы - это элементы главной подгруппы I и II групп. По факту это элементы у которых заполняется s-уровень. В каждом периоде по 2 s-элемента.
42. р-элементы - это элементы III-VIII групп, главных подгрупп. Это элементы у которых заполняется р-уровень. Всего 6 р-элементов в каждом периоде (кроме первого, их там нет; и седьмого - хотя там тоже их 6 штук).
43. d-элементы - это элементы I-VIII групп, побочных подгрупп. Это элементы у которых заполняется d-уровень. В каждом большом периоде по 10 d-элементов.
Объяснение:
Расставляем степени окисления.Смотрим какие вещества изменили степени окисления,до и после реакции.
Ag(0)>Ag(+1) | -1e значит это восстановитель
S(+6)>S(+4) | +2e значит это окислитель
Теперь 2:1=2
2:2=1