Объяснение:
1.
а) 2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3↑ + 2H2O
б) Ca(OH)2 + 2NH4NO3 = Ca(NO3)2 + 2NH3↑ + 2H2O
2.
а) 2NH3 + H3PO4 = (NH4)2HPО4 Реагує з кислотами як основа
. Амоній гідрогенфосфат
б) 2NH3 + 3CuO = 3Cu + N2 + 3H2O Амоніак є відновником
N⁻³H3 + Cu⁺²O → Cu⁰ + N2⁰ + H2O
2N⁻³ - 6e- → N2⁰ 6│ 6│1 Відновник
Cu⁺² + 2e- → Cu⁰ 2│ │ 3 Окисник
3.
N2+3H2=2NH3
NH3 + H2O = NH4OH
NH4OH + HCl = NH4Cl + H2O
NH4Cl=t°С=NH3↑+HCl
4NH3+5O2 = 4NO+3H2O
2NO+O2 =2NO2
NO2+H2O+O2 = HNO3
HNO3+NH3 = NH4NO3
Для того, чтобы отличить азот (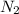 ) и кислород (
) и кислород (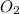 ) нужно вспомнить, что из них горит и как происходит процесс горения. Азот поддерживает горение при очень высоких температурах, а кислород будет поддерживать горение при нормальных условиях. Впрочем, давайте, к примеру, представим 2 колбы в виде цилиндра: в одной поместим чистый кислород, а в другой - чистый азот. Также стоит отметить, что оба вещества - газы, значит, они заполнят весь объём каждого из сосудов. Теперь давайте возьмем спичку и подожжем её. Если поднести тлеющую лучину спички к кислороду, то она будет гореть и дальше, а если быть точнее, то начнет разгораться, если же к азоту - то она рано или поздно перестанет гореть, так как было сказано ранее: такое вещество, как азот горит при высоких температурах. Вследствие этого, можно сделать вывод, что отличить азот от кислорода не составит труда, если просто-напросто поднести обычную спичку к какому-либо сосуду, заполненному тем или иным газом.
) нужно вспомнить, что из них горит и как происходит процесс горения. Азот поддерживает горение при очень высоких температурах, а кислород будет поддерживать горение при нормальных условиях. Впрочем, давайте, к примеру, представим 2 колбы в виде цилиндра: в одной поместим чистый кислород, а в другой - чистый азот. Также стоит отметить, что оба вещества - газы, значит, они заполнят весь объём каждого из сосудов. Теперь давайте возьмем спичку и подожжем её. Если поднести тлеющую лучину спички к кислороду, то она будет гореть и дальше, а если быть точнее, то начнет разгораться, если же к азоту - то она рано или поздно перестанет гореть, так как было сказано ранее: такое вещество, как азот горит при высоких температурах. Вследствие этого, можно сделать вывод, что отличить азот от кислорода не составит труда, если просто-напросто поднести обычную спичку к какому-либо сосуду, заполненному тем или иным газом.
Примечание: подобный метод используется при различии водорода от кислорода. С кислородом будет то же самое, что и было описано выше. Водород же будет производить хлопок при поднесении спички к данному газообразному веществу. Очень часто эксплуатируют данную методику для определения газообразных веществ.
1)
Объяснение:
Во время окисления атом/ион отдаёт свой электрон другому атому, а значит его степень окисления возрастает (электрон имеет отрицательный заряд, следовательно вместе с электроном ион отдаёт и его отрицательный заряд, то есть общий заряд иона становится больше)
В первом варианте у иона была степень окисления (-2), а стала (+4), то есть стала больше. В остальных вариантах заряд наоборот уменьшался.
На последней странице учебника по химии есть таблица "растворимость кислот, оснований и солей в воде". Сверху написаны Катионы - их ставишь вначале формулы, Сбоку Анионы - их в конце. Если тебе нужно узнать проводит ли данное вещество ток (то есть растворяется в воде или диссоциирует), просто смотришь какая буква написана на пересечении нужного катиона и аниона. Если "Р" или "М", то это вещество растворяется и диссоциирует, а значит и проводит ток. Если "Н", то не растворяется, не диссоциирует, не проводит ток. К примеру у нас вещество Сульфат магния MgSO4. Mg это катион, он отображен на верху. SO4 это анион, он сбоку. Проводим воображаемую черту от Магния вниз по таблице и от SO4 вправо по таблице. На месте их пересечения будет видно, растворимо ли вещество или нет. В нашем случае там буква Р, значит оно растворимо. Теперь сможешь решать без чьей-либо Надеюсь понятно объяснил.