акономерности изменения химических свойств элементов и их соединений по периодам и группам.
Перечислим закономерности изменения свойств, проявляемые в пределах периодов:
- металлические свойства уменьшаются;
- неметаллические свойства усиливаются;
- степень окисления элементов в высших оксидах возрастает от +1 до +7 (+8 для Оs и Ru);
- степень окисления элементов в летучих водородных соединениях возрастает от -4 до -1;
- оксиды от основных через амфотерные сменяются кислотными оксидами;
- гидроксиды от щелочей через амфотерные сменяются кислотами.
Д. И. Менделеев в 1869 г. сделал вывод – сформулировал Периодический закон, который звучит так:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образуемых ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы – группы.
Иногда, в нарушение выявленной им закономерности, Менделеев ставил более тяжелые элементы с меньшими значениями относительных атомных масс. Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, аргон перед калием. Такой порядок расположения Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов, в частности, щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон – в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, не мог объяснить и причину периодичности свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома, внутреннее строение которого в то время не было изучено.
В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т. е. раскрывают физический смысл номера периода, номера группы и порядкового номера элемента.
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы.
Эти два важнейших значения Периодического закона и Периодической системы дополняет еще одно, которое заключается в , т.е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов
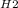 (в дальнейшем я буду писать просто D, а ты пиши как в первом случае)
(в дальнейшем я буду писать просто D, а ты пиши как в первом случае)
1.Где содержится больше молекул:
а) в 15г. муравьиного альдегида- НСНО или в 5.6 л. (н.у.)C₂H₆- этана ?
б) в 3.8 г.фтора F₂ или в 11.2 л. (н.у.) хлороводорода HCl?
в) в 4.4 г. пропана С₃Н₈ или в 0.1 моль СО₂?
2. Какой объем займут 1.67·10²³ CO₂
Решение: (знак÷ это деление)
а) M(HCHO) =1+16+1+16=34г.
m(HCHO)=15г.
n( HCHO)= m÷M=15÷34=0,44моль
Na(HCHO)=6·10²³ молекул
N(HCHO)=n x Na= 0,44×6·10²³= 2,64·10²³молекул
Vm( C₂H₆) =22,4л.
n(C₂H₆)= V÷Vm= 5,6÷22,4=0,25моль
Na(C₂H₆)=6·10²³молекул
N(C₂H₆)= n x Na=0,25×6·10²³=1.5·10²³ молекул
Вывод: в 15 г. HCHO больше молекул чем 5,6л.C₂H₆
б) M(F₂) =19г.
m(F₂) = 3.8г.
n(F₂)= m÷M= 3.8÷19= 0.2моль
Na(F₂) = 6·10²³молекул
N(F₂)= nxNa= 0,2×6·10²³= 1.2·10²³молекул
Vm=22,4л.
V(HCl)=11,2л.
n(HCl)= V÷Vm =11,2÷22,4=0,5моль Na(HCl)=6·10²³молекул
N(HCl)= n x Na= 0,5×6·10²³=3·10²³ молекул
Вывод: в 11,2л.HCl больше молекул чем в3,8г.F₂
в) M(C₃H₈) =12х3+1х8=44г.
m(C₃H₈)=4,4г.
n(C₃H₈)=m÷M=4,4÷44=0,1моль
Na(C₃H₈)=6·10²³молекул
N(C₃H₈)= n x Na =0,1×6·10²³= 0,6·10²³молекул
Vm(CO₂)=22,4л./моль n(CO₂)=0,1моль
Na(CO₂)= 6·10²³ молекул
N(CO₂)= n x Na= 0,1×6·10²³=0,6·10²³ молекул
Вывод: в 4,4г. C₃H₈ и в 0,1моль CO₂ одинаковое число молекул.
2. Какой объем займут 1.67·10²³ CO2
Vm (CO₂)= 22.4л.моль Na (CO₂)= 6·10²³ молекул
Задачу решаем используя формулы:
1. n= N÷Na n=1.67·10²³ ÷ 6·10²³=0,278моль
2. V=Vm×n= 22,4л.×0,278моль=6,23л.
ответ: 1.67·10²³ CO2 займет объем 6,23л.