1) реакция не пойдёт,т.к. Cu менее активные,чем H,и Cu не вытеснит H
(Растворимые кислоты реагируют с металлами,только при условии,что металл стоит до H в ряду активности металлов)
2)реакция пойдёт
3)реакция пойдёт,только при температуре 110-150 градусов,а так нет,т.к. кислота с кислотой не реагирует.
4)реакция не пойдёт,т.к кислоты не реагируют с кислотными оксидами
5)реакция пойдёт
6)реакция пойдёт
7)реакция не пойдёт,т.к. признака реакции не будет,то есть осадка,всё раствориться
8)реакция пойдёт
9)реакция пойдёт
Все реакции,которые идут,записаны на листочке в молекулярном,полном ионном и сокращённом ионном уравнениях
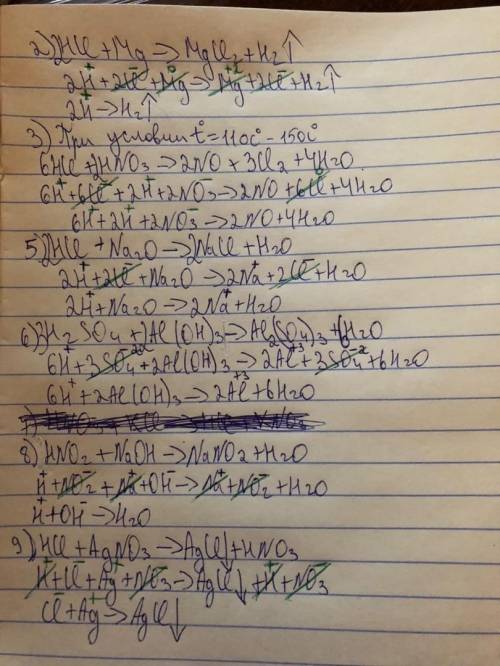
1) реакция не пойдёт,т.к. Cu менее активные,чем H,и Cu не вытеснит H
(Растворимые кислоты реагируют с металлами,только при условии,что металл стоит до H в ряду активности металлов)
2)реакция пойдёт
3)реакция пойдёт,только при температуре 110-150 градусов,а так нет,т.к. кислота с кислотой не реагирует.
4)реакция не пойдёт,т.к кислоты не реагируют с кислотными оксидами
5)реакция пойдёт
6)реакция пойдёт
7)реакция не пойдёт,т.к. признака реакции не будет,то есть осадка,всё раствориться
8)реакция пойдёт
9)реакция пойдёт
Все реакции,которые идут,записаны на листочке в молекулярном,полном ионном и сокращённом ионном уравнениях
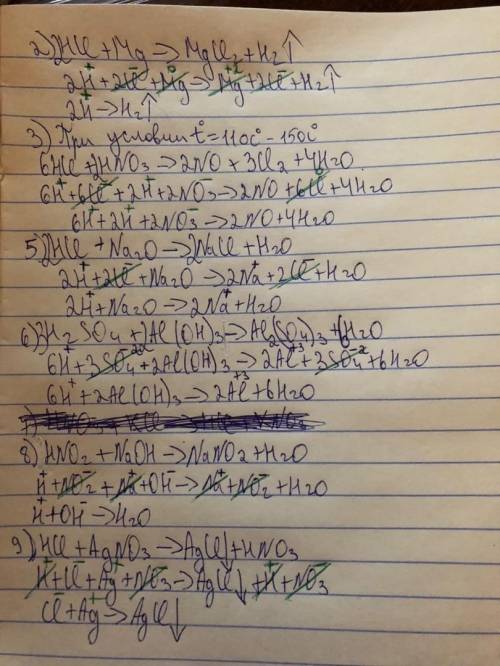
Образование белого творожистого осадка при реакции с нитратом серебра - качественная реакция на хлорид-ионы. Следовательно, вещество Б - хлорид калия (KCl)
KCl + AgNO3 = AgCl + KNO3
Г - хлорид серебра
Хлорид калия образуется при термическом разложении хлората калия в присутствии оксида марганца (IV):
2KClO3 = 2KCl + 3O2
Следовательно, А - хлорат калия (KClO3); В - кислород
Металл, имеющий красноватый цвет - медь. Черный цвет имеет оксид меди (II)Следовательно, Д - медь; Е - оксид меди (II)
2Cu + O2 = 2CuO
Рассчитаем количество хлорида серебра.
2Cu + O2 = 2CuO
х г 48 г
32 г 2*80 г
х = 9,6 г
2KClO3 = 2KCl + 3O2
х г 9,6 г
2*74,5 г 3*32 г
х = 14,9 г
KCl + AgNO3 = AgCl + KNO3
14,9 г х г
74,5 г 143,5 г
х = 28,7 г
ответ: А - хлорат калия; Б - хлорид калия; В - кислород; Г - хлорид серебра (I); Д - медь; Е - оксид меди (II)