В наиболее общей формулировке горение представляет собой быстро протекающую физико-химическую реакцию с выделением тепла и света. В природе и в технике чаще всего наблюдаются процессы горения, связанные с окислением горючих веществ кислородом воздуха. Однако многие вещества вступают между собой в реакцию горения и при отсутствии кислорода. Так, водород и некоторые металлы горят в газообразном хлоре, медь — в парах серы, алюминий в броме и т. п.
Наряду с реакциями горения, протекающими в результате химического соединения различных веществ, происходят реакции горения, связанные с разложением газов, жидкостей и твердых веществ (ацетилен, нитроглицерин, нитроклетчатка, азид свинца и др.).
Объяснение:
правильно
Объяснение:
Для решения воспользуемся правилом креста
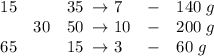
Отняв по диагонали меньшее от большего получим соотношения масс начальных растворов. Сократили на 5 (после стрелок)
Делаем вывод: для получения 10 частей 30%-го раствора нужно смешать 7 частей 15%-го и 3 части 65%-го растворов. Так как эти 10 частей конечного раствора имеют массу 200 г, то по пропорции нетрудно посчитать сколько это будет для 7 и 3 частей начальных растворов, а именно для получения 200 г 30%-го раствора нужно смешать 140 г 15%-го и 60 г 65%-го растворов.
m(Cu) + m(Fe)=25г.
V(газа)=8,96л.
Vm =22,4л./моль
m(Cu)-? m(Fe)-?
1. Разбавленная серная кислота с медью не взаимодействует. Значит с серной кислотой взаимодействует железо.
2. Запишем уравнение реакции взаимодействия серной кислоты с железом:
Fe + H₂SO₄ = FeSO₄ + H₂
3. Определяем количество вещества n водорода объемом 8,96л по формуле:
n=V÷Vm n(H₂)=8,96л.÷ 22,4л./моль= 0,4моль.
4. Анализируем уравнение реакции из 1 моль железа получается 1моль водорода, значит если выделяется 0,4моль водорода, то в реакцию вступило тоже 0,4 моль железа.
5. Определяем массу железа количеством вещества 0,4моль по формуле:
m= n×M M(Fe)=56г./моль m(Fe)= 0,4моль×56г.моль=22,4г.
6. Определяем массу в смеси меди:
m(Cu) =25г - 22,4г.= 2,6г.
7. ответ: В смеси 25г. металлов 22,4г железа и 2,6г. меди.