Дано:
m (MeO) = 5,6 г;
m (HCl) = 25 г;
ω (HCl) = 29,2 %.
Найти:
Me (металл) — ?
1. Так как это оксид двухвалентного металла, мы можем записать реакцию в общем виде.
MeO + 2HCl → MeCl₂ + H₂O.
2. Найдём массу чистого HCl.
m (HCl) = (29,2 % · 25 г) ÷ 100 = 7,3 (г) - чистого HCl.
3. Теперь найдём количество вещества (моль) HCl. По формуле: n = m ÷ M; где: n - количество вещества (моль), m - масса (г), M - молярная масса (г/моль).
n (HCl) = 7,3 г ÷ 36,5 г/моль = 0,2 (моль).
4. Через соотношение количества вещества MeO и HCl найдём число моль MeO.
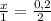 ; x = 0,1 (моль) - MeO.
; x = 0,1 (моль) - MeO.
5. Нам известна масса и количество вещества оксида металла. Теперь найдём молярную массу по формуле: M = m ÷ n; где: M - молярная масса (г/моль), m - масса (г), n - количество вещества (моль).
M (MeO) = 5,6 г ÷ 0,1 моль = 56 (г/моль).
6. Из найденной молярной массы вычтем кислород и узнаем молярную массу металла.
56 г/моль - 16 г/моль = 40 (г/моль).
Смотрим по таблице Менделеева... Это кальций (Ca).
ответ: CaO.
Задание 1
Дано:
m(C)=1,2г
Найти:
V(F2)-?
C+2F2=CF4
n(C) =m/M=1,2г:12г/моль=0,1моль
M(C) =12г/моль
n(C)=n(F2)=0,1моль*2/1=0,2моль
V(F2)=Vm*n=22,4л/моль*0,2моль=4,48л
Задание 2
Дано:
V(Cl2) =6,72л
Найти:
m(Al) -?
2Al+3Cl2 =2AlCl3
n(Cl2)=V/Vm=6,72л:22,4л/моль=0,3моль
n(Cl2)=n(Al)=0,3*2/3=0,2моль
m(Al)=n*M=0,2моль*27г/моль=5,4г
M(Al)=27г/моль
Задание 3
Дано
m(I2)=2,54г
Найти:
m(CaI2)-?
Ca+I2=CaI2
n(I2) =m/M =2,54г:254г/моль=0,01моль
M(I2) =127*2=254г/моль
n(I2) =n(CaI2) =0,01моль
m(CaI2)=n*M=0,01моль*294г/моль=2,94г
M(CaI2)=40+127*2=294г/моль