х г 0,56 л
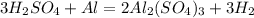
279 г 67,2 л
1. Найдем чистую массу кислоты,необходимую для образования 0,56 л водорода:
при взаимодействии 279 г кислоты выделяется 67,2 л водорода, а
при -- // -- // -- х г_____________________0,56 л, откуда
х=279*0,56/67,2=2,325 г
2. Учитывая,что полученная масса кислоты - это всего лишь 20% в растворе,тогда:
2,325 г кислоты - это 20%, а
у г раствора________100%, откуда у=2,325*100/20=11,625 или приблизительно 12 г
1) ZnCl2 + H2SO4 ( конц) => ZnSO4 + 2HCl
HCl + KOH => KCl + H2O
2KCl + F2 => 2KF + Cl2
Cl2 + 2KI => 2KCl + I2 я так поняла, что Y это йод
I2 + H2 => 2HI
дальше не понятно откуда получить AgCl
HCl ( или KCl) + AgNO3 => AgCl + HNO3 (или KNO3)
2) эндотермическая, обратимая, разложение, окислительно-восстановительная, некаталитическая,
для смещения расматриваем принцип Ле-ШАтелье
- давление уменьшить ( в сторону больших объемов)
-температуру увеличить ( в сторону эндо)
-концентрацию SO3 - увеличить , а SO2 и О2 уменьшить
3) 10HNO₃+4Mg=>4Mg(NO₃)₂+N₂O+5H₂O
Mg (0) -2e(-) > Mg (+2) 2 4 восстановитель, окисление
8
N(+5) +8e(-) > N(+1) 8 1 окислитель, восстановление
ответ: 1,2 кг; 0,3 кг
Дано:
m(p-paHNO₃) = 1,5 кг
ω(HNO₃) = 20% или 0,2
Найти:
m(H₂O) - ?
m(HNO₃) - ?
Объяснение:
Раствор состоит из растворенного вещества (HNO₃) и растворителя (Н₂О). Из формулы ω = m(р.в./m(p-pa) найдем массу азотной к-ты:
m(HNO₃) = m(p-paHNO₃)*ω(HNO₃) = 1,5 кг*0,2 = 0,3 кг
Находим массу растворителя (воды):
m(H₂O) = m(p-pa) - m(HNO₃) = 1,5 кг - 0,3 кг = 1,2 кг
ответ: 1,2 кг; 0,3 кг