Задача №1
- Уравнение:
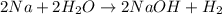
- вычислим количество вещества водорода:
n = V/Vm = 4,48л/22,4л/моль = 0,2 моль
- По уравнению реакции:
n(Na) = 2n(H2) = 0.2моль*2 = 0,4 моль
- Вычисляем массу натрия:
m(Na) = n*M = 0,4моль*23г/моль = 9,2 грамма
Отвеот: масса натрия равна 9,2 грамма
Задача №2
- Уравнение:
CuO + H2 = Cu + H2O
-По уравнению реакции, видим, что:
n(H2) = n(CuO) = 1,5 моль
- Масса 1,5 моль водорода:
m= n*M = 2г/моль*1,5моль = 3 грамма
- По уравнению реакции, видим, что:
n(Cu) = n(CuO) = 1.5 моль
- Рассчитывеам массу 1,5 моль меди:
m = n*M = 1,5 моль*64г/моль = 96 грамм
P2O5 + 3H2O = 2H3PO4
m(P) = 1 кг = 1000 г
1000 г (Р) 100 %
х г(Р) 93 %
х = 1000*93/100 = 930 г (масса чистого фосфора)
M(P) = 31 г/моль
n(P) = m/M = 930/31 = 30 моль
n(P2O5) = n(P)/2 = 30/2 = 15 моль
n(H3PO4) = 2n(P2O5) = 15*2 = 30 моль
M(H3PO4) = 1*3+31+16*4 = 98 г/моль
m(вещества H3PO4) = n*M = 30*98 = 2940 г
m(раствора H3PO4) = m(вещества)/w(H3PO4) = 2940/0,1 = 29400 г = 29,4 кг