Пускай масса кислорода равна х г.
Тогда масса искомого элемента равна (х + 87,5) г.
Зная, что их сумма равна 175 г, составим уравнение:
х + (х + 87,5) = 175;
х + х + 87,5 = 175;
2х + 87,5 = 175;
2х = 175 - 87,5;
2х = 87,5;
х = 43,75 (г) — масса кислорода в оксиде.
Найдем молярную массу кислорода:
M (O₂) = 2 ∙ Ar(O) = 2 ∙ 16 = 32 (г/моль).
Значит, масса кислорода в 1 моле оксида равна 32 г.
Масса кислорода в n моль оксида равна 43,75 г.
Составим пропорцию и выразим из нее количество вещества ХО₂:
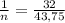 ;
;
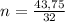 ;
;
 (моль).
(моль).
Судя по формуле соединения, 1 моль оксида содержит 1 моль неизвестного элемента, то есть n (ХО₂) = n (Х).
Формула количества вещества:
n = m : M.
Отсюда выразим молярную массу:
M = m : n.
Масса искомого элемента равна m (O₂) + 87,5 = 43,75 + 87,5 = 131,25 (г).
M (X) = m (X) : n (X) = 131,25 : 1,37 = 96 (г/моль).
Смотрим в таблице Менделеева, какой элемент имеет такую атомную массу, и это молибден (Mo). Это и есть элемент, образовавший данный оксид.
ответ: молибден (Mo).
При отсутствии в условии ошибок ("выделился водород объемом 6.72 л", а не "смесь газов объемом 6.72 л"), напрашивается след-ий вариант решения: n SiO2 = 24/60=0.4 моль, n Mg = 28.8/24=1.2 моль, ур-е р-ии в соот-ии с условиями задачи: 2Mg + SiO2 = 2MgO + Si;
магний нах-ся в избытке равном 1.2-(0.4*2)=0.4 моль и теоретически в р-ии с соляной к-ой по ур-ю Mg + 2HCl = MgCl2 + H2 должен выд-ся водород объемом 22.4*0.4=8.96 л, фактически же выд-ся объем 6.72 л (6.72/22.4=0.3 моль) , т. е. в магнии нах-ся примеси с м. д. равной ((0.4-0.3)/1.2)*100=8.33%;
Объяснение:
n(H2S) = m/M
n(H2S) = 5,1г /34г/моль =0,15моль
n(H2S) = n(SO2)
m(SO2) = nxM
m(SO2) = 0,15моль x 64г/моль = 9,6 г
ПО уравнению количественные отношения сероводорода и кислорода:
0,15/2 =x/3
x = 0,225моль
V(O2) = n xVm
V(O2) = 0,225 моль x 22,4л/моль =5,04л