При добавлении к раствору солей нитрата и хлорида натрия нитрата серебра реакция идет только между хлоридом.
NaCl + AgNO3 -> AgCl (осадок) + NaNO3
Раствор нитрата серебра в избытке, значит прореагирует весь хлорид и количество осадка (3,15 г) будет в пропорции к исходному хлориду. Реакция уравненна (моль хлорида натрия дает моль осадка) .
Молек. масс NaCl = 23 +35 =58 г
Молек. масс AgCl = 108 +35 =143 г
Составим пропорцию: 58г - 143 г
х - 3,15г
х = 3,15*58/143=1,28 г.
Значит в исходной смеси было 1,28 г NaCl и 4,86 - 1,28 =3,58 г NaNO3.
Теперь считаем массовые доли солей.
Весь раствор имеет массу 4,86+35,14 =40 г.
Тогда содержание С NaCl будет:
40 г - 100%
1,28 г - С NaCl С NaCl = 1,28*100/40 = 3,2%
Аналогично С NaNO3 = 3.58*100/40 =8.95%
№1:
а - 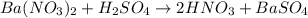
б - 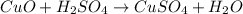
в - 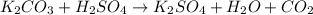
г - 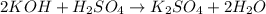
Про тесения реакций - извини, не очень понял, что требуется?
№3
Качественная реакция на сульфат - анион есть реакция с катионами бария: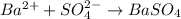 - выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
- выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
№4 В обе пробирки добавить несколько мл гидроксида бария. В пробирке с соляной кислотой пройдет обычная нейтрализация, видимых изменений не наблюдается, а в пробирке с серной кислотой выпадет белый осадок сульфата бария(ионные уравнения приведены выше)
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов