1.Сначала необходимо содержимое всех трех пробирок разделить пополам,каждую пару пронумеровать:1-1,2-2,3-3.Потом в первую тройку добавить щелочь,где выпадет студенистый осадок - это был раствор хлорида цинка:
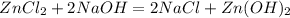 - стрелка вниз (осадок)
- стрелка вниз (осадок)
2.Остальные пробирки с растворами,например остались 2 и 3,откладываем,но берем те же номера из второй тройки и добавляем в обе раствор серной кислоты.Где произойдет вскипание массы,там будет карбонат натрия,так как будет выделятся углекислый газ,который образуется в результате разложения нестойкой угольной кислоты,которая образовалась в результате реакции:
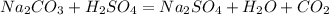 - стрелочка вверх (газ)
- стрелочка вверх (газ)
3. В другой пробирке никаких изменений не произойдет,значит это сульфат натрия
85,5 г,х г 7,8 г у л
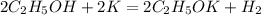
92 г 78 г 22,4 л
1. Сначала переведем объем раствора в массу через плотность(учитывая что 0,8 г/см в кубе = 0,8 г/мл):
m(раствора)=V(раствора)*р(ро)=112,5*0,8=90 г
2. Теперь определим чистую массу спирта в растворе:
m(C2H5OH)=m(раствора)*w(C2H5OH)=90*0,95=85,5 г
3. Теперь все данные и полученные массы веществ подставив в уравнение,определим,какое из исходных веществ прореагирует полностью(без остатка),приняв массу одного из веществ за Х,например спирта,то получим:
для полного взаимодействия 92 г спирта необходимо 78 г калия, а
для -- // -- х г__________________7,8 г, откуда
х=92*7,8/78=9,2 г
4.Так как согласно расчетам на 7,8 г калия необходимо 9,2 г,а мы рассчитали,что у нас в наличии 85,5 г спирта,значит он дан в избытке.Поэтому расчет объема ведем по массе калия,который прореагирует полностью:
при взаимодействии 78 г калия выделится 22,4 л водорода, а
при -- // -- 7,8 г_______________у л, откуда
у=7,8*22,4/78=2,24 л
Fe + CuCl2 = FeCl2 + Cu
Ca + 2HCl = CaCl2 + H2
2H2 + O2 = 2H2O