 моль ⇒ n(C)=0,3 моль
моль ⇒ n(C)=0,3 моль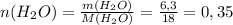 моль ⇒ n(H)=0,7 моль
моль ⇒ n(H)=0,7 моль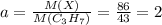
Первой реакцией является реакция с хлоро-содержащим окислителем (реакция с HCl не подходит из-за слабой окислительной вместо Железа (3) получим Железо (2))
1) 2Fe+3Cl2=2FeCl3;
Поскольку гидроксид железа (3) - нерастворимое вещество, можно его получить реакцией со щелочью:
2) FeCl3+3NaOH=Fe(OH)3+3NaCL;
Разложение термически неустойчивого гидроксида приводит к оксиду железа (3):
3)2Fe(OH)3=Fe2O3+3H2O (разложение при температуре);
Восстановление оксида железа (3) водородом при повышенной температура даст желаемый продукт:
4) Fe2O3+3H2=2Fe+3H2O.
общая формула: R - O R' (R- углеводородные радикалы разные или одинаковые)
физ.св-ва:
сложные эфиры - бесцветные жидкости, некоторые кристаллические в-ва. Большинство имеет приятный запах. Кипят при более низких температурах.
хим. св-ва:
простые эфиры химически инертные вещества.
1)Они подвергаются гидролизу в присутствии кислоты или щелочи:
CH₃COOCH₃ + H₂O --> CH₃COOH + CH₃OH (уксусная к-та и метанол)
2) др. св-ва в фото.
применение:
Этилформиат НСООС₂Н₅ и этилацетат Н₃СООС₂Н₅ используются как растворители целлюлозных лаков (на основе нитроцеллюлозы и ацетилцеллюлозы).Сложные эфиры на основе низших спиртов и кислот. используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей