Решить зачета 3 вариант 1 1. речь идет о простом веществе водород: а) входит в состав кислот; б) чистый водород спокойно горит; в) в молекуле гидрида кальция содержится два атома водорода; г) основной элемент вселенной. 2. самый легкий газ: а) не; б) н2; в) со2; г) о2. 3. в лаборатории водород получают при взаимодействии кислоты с: а) cu; б) ag; в) zn; г) pt. 4. водород собирают вытеснения: а) воздуха, держа сосуд горизонтально; б) воздуха, держа сосуд вниз дном; в) воды, держа сосуд вниз дном; г) воды, держа сосуд вверх дном. 5. «гремучий газ» – смесь водорода с кислородом в соотношении: а) 2: 1; б) 1: 1; в) 1: 2; г) произвольном. 6. массовая доля водорода в воде равна: а) 0,6; б) 0,5; в) 0,4; г) 0,1. 7. реагирует с водородом при обычных температурах: а) о2; б) cl2; в) s; г) f2. 8. уравнение реакции и название продукта верны для: а) n2 + 3h2 = 2nh3, азотоводород (аммиак); б) ti + h2 = tih2, оксид титана; в) н2 + о2 = н2о, вода; г) н2 + s = h2s, гидрид серы. 9. относится к реакции восстановления: а) сuо + н2 = сu + н2о; б) zn + 2hcl = zncl2 + h2; в) zn + s = zns; г) 4р + 5о2 = 2р2о5. 10. реактивами в цепочке превращений сu сuо сu являются: а) н2 и о2; б) о2 и н2; в) н2о и н2; г) о и н. 11. выберите формулу гидрида натрия: а) nа2o; б) nаoн; в) nah; г) na2so4. дополнительная часть 12. имеет самую низкую температуру кипения: а) о2; б) н2; в) n2; г) не. 13. по уравнению 2н2 + о2 = 2н2о + 571 кдж рассчитайте (в кдж) количество теплоты, выделившееся при сгорании 10 г н2. а) 2855; б) 5710; в) 1427,5; г) 3426. 14. сколько граммов кальция прореагирует с 4 г водорода? а) 20; б) 40; в) 80; г) 160. 15. водород в лаборатории получают при действии кислот на некоторые металлы. при этом атомы водорода в кислотах замещаются атомами металлов. напишите уравнения взаимодействия соляной (нсl) и серной (н2so4) кислот с алюминием и цинком. 16. в двух стеклянных колбах без этикеток находятся кислород и водород. определите, в какой колбе какой газ находится.
1. Речь идет о простом веществе водород: б) чистый водород спокойно горит;
2. Самый легкий газ:б) Н2;
3. В лаборатории водород получают при взаимодействии кислоты с:в) Zn;
4. Водород собирают вытеснения:г) воды, держа сосуд вверх дном.
5. «Гремучий газ» – смесь водорода с кислородом в соотношении: а) 2:1;
6. Массовая доля водорода в воде равна:г) 0,1
7. Реагирует с водородом при обычных температурах: б) Cl2;
8. Уравнение реакции и название продукта верны для:в) Н2 + О2 = Н2О, вода;
9. Относится к реакции восстановления: а) СuО + Н2 = Сu + Н2О;
10. Реактивами в цепочке превращений Сu СuО Сu являются: б) О2 и Н2;
11. Выберите формулу гидрида натрия:в) NaH;
12. Имеет самую низкую температуру кипения: б) Н2;
13. По термохимическому уравнению 2Н2 + О2 = 2Н2О + 571 кДж рассчитайте (в кДж) количество теплоты, выделившееся при сгорании 10 г Н2: в) 1427,5;
14. Сколько граммов кальция прореагирует с 4 г водорода: в) 80;
15.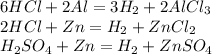
16.Если колбы невозможно открыть,то определить можно по весу(на точных аналитических весах):какая из колб легче,там и водород.В ином случае,необходимо поднести тлеющую лучину,в которой вспыхнет-это кислород,в иной услышим хлопок-водород