15.1
Al2(SO4)3 - сульфат аллюминия
Ba(NO3)2 - нитрат бария
NaAlO2 - метаалюминат натрия
K2CO3 - карбонат калия
FeCl3 - хлорид железа (III)
Na3AsO4 - арсенат натрия
AgI - йодид серебра
Na2SiO3 - силикат натрия
15.2
HNO2 - соотетствующим оксидом будет N2O3
Be(OH)2 - соотетствующим оксидом будет BeO
HIO3 - соотетствующим оксидом будет Cl2O5
H2CrO4 - соотетствующим оксидом будет CrO3
Cr(OH)3 - соотетствующим оксидом будет Cr2O5
15.3
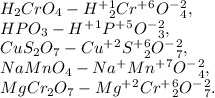
15.4
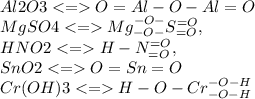
15.5
ZnSO4 → Zn(OH)2 → ZnCl2 → AlCl3 → Al(OH)3.
ZnSO4 +NaOH = Na2SO4 + Zn(OH)2;
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O;
3ZnCl2 + 2Al = 2AlCl3 + 3Zn;
AlCl3 + 3NaOH = 3NaCl + Al(OH)3
2) В ОВР кислоты с металлами металлы отдают электроны, выступая как восстановители: Ме-хе=Ме +х
Ионы водорода в кислотах (протоны), принимают электроны, восстанавливаясь до молекулярного водорода
2Н+ +2е=Н2
3) а)определим массу соли в исходном растворе 200*0,5=100г
б) Определим массу соли в конечном растворе 100+10=110 г
в) масса раствора увеличивается на массу соли 200+10=210
г) найдем концентрацию конечного раствора 110/210=0,5238 или 52,38%